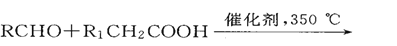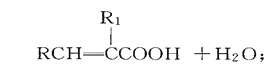-
化学与生产、生活、社会密切相关,下列有关说法正确的是( )
A. 合成纤维和光导纤维都是新型无机非金属材料
B. 糖类、植物油和蚕丝在一定条件下都能够发生水解反应
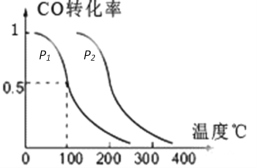
C. 新型高效催化技术可实现汽车尾气中的NO和CO转化为N2和CO2,减少空气污染
D. 漂白粉和SO2都可以用来作漂白剂且漂白原理相同
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 1 mol SO2溶于足量水,溶液中 H2SO3、HSO3-与 SO32-粒子的物质的量之和为 NA
B. 34g H2O2中含有的化学键数目为3NA
C. 常温常压下,17 g 甲基(—14CH3)所含的中子数为 11NA
D. 22.4L Cl2在一定条件下与铁粉完全反应,转移电子数为2NA
难度: 中等查看答案及解析
-
下列有关常见有机物说法正确的是 ( )
A. 苯和乙烯均能使酸性高锰酸钾溶液褪色
B. 可用水来除去溴苯中的溴单质
C. 使用聚乙烯塑料和聚氯乙烯塑料可减少白色污染
D. 苯乙烯能在一定条件下合成高分子化合物
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的质子数与X原子的次外层电子数相等,Y的电子层数与其主族序数相同,Z元素的单质常用来制备消毒剂。下列说法正确的是( )
A. 原子半径:X > Y > Z > W
B. X与Y元素的最高价氧化物的水化物一定能发生反应
C. 工业上常用电解Y和Z形成的化合物来制备Y单质
D. W与X形成的化合物中只含有离子键
难度: 中等查看答案及解析
-
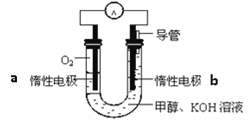
某锂-空气电池放电时的工作原理如图所示。下列叙述正确的是( )
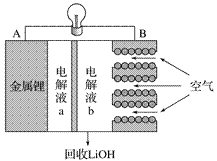
A. 放电时电子由B极经导线向A极移动
B. 电池放电时B电极的反应式为O2 +2H2O + 4e-===4OH -
C. 电解液a、b之间可采用阴离子交换膜
D. 当A电极消耗14g金属锂时,B电极有标况下22.4L氧气参与反应
难度: 中等查看答案及解析
-
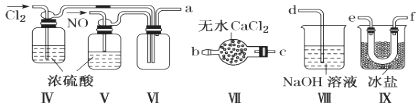
根据下列实验操作和现象所得到的结论不正确的是
选项
实验操作和现象
实验结论
A
取某溶液于试管中,滴入氢氧化钠溶液并加热,试管口处湿润的红色石蕊试纸变蓝
该盐中含NH4+
B
向海带灰提取液中加入稀硫酸酸化的H2O2,充分振荡后,滴加四氯化碳,振荡静置,下层呈紫红色
海带灰提取液中存在I-
C
纯净的SO2和Cl2分别通过盛有品红溶液的试管,溶液均褪色
SO2和Cl2都有漂白性
D
铁粉中加入的过量稀硝酸,充分反应后,滴入KSCN溶液,溶液变为红色
硝酸将铁氧化,生成Fe3+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
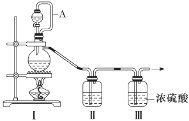
海水约占地球表面积的71%,具有十分巨大的开发潜力。下图是开水资源综合利用的工艺图,以下说法正确( )

A. 电解NaCl溶液时可用铁做电极,其离子方程式为:2Cl- + 2H2O = 2OH-+ H2↑+ Cl2↑
B. 向苦卤中加入Cl2的作用是置换出溴单质,该过程体现了还原性:Cl- > Br-
C. 实验室模拟海水提取淡水,除夹持装置外只用到的仪器有蒸馏烧瓶、酒精灯、锥形瓶
D. Br2 与SO2的水溶液发生反应的离子方程式为:Br2 + SO2 + 2H2O =4H+ + 2Br- + SO42-
难度: 中等查看答案及解析