-
下列关于胶体和溶液的说法正确的是( )
A. 制备氢氧化铁胶体时,可以将饱和FeCl3溶液滴入沸水,然后长时间煮沸
B. 溶液呈电中性,胶体带有电荷
C. 溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
D. 胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100nm之间
难度: 简单查看答案及解析
-
下列各组离子在给定条件下能大量共存的是( )
A. 在某无色透明的溶液中:NH4+、K+、Cu2+、C1-
B. 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I-
C. 使石蕊试液变红的溶液中:HCO3-、NH4+、NO3-、K+
D. 在强碱溶液中:Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的化学原理是:4Ag + 2H2S + O2 =2X + 2H2O。下列说法正确的是( )
A. X 的化学式为 AgS
B. 反应中 Ag 和H2S 均是还原剂
C. 银针验毒时,空气中氧气失去电子
D. 每生成 1molX,反应转移 2mol 电子
难度: 中等查看答案及解析
-
小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是( )。
A. 溶解度(s) B. 物质的量浓度(c)
C. 质量分数 D. 摩尔质量(M)
难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A. 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑
B. 用小苏打治疗胃酸过多:HCO3﹣+H+═CO2↑+H2O
C. 锌片插入硝酸银溶液中:Zn+Ag+═Zn2++Ag
D. 硫酸溶液与氢氧化铜反应:H++OH﹣═H2O
难度: 中等查看答案及解析
-
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 萃取 B. 渗析 C. 蒸馏 D. 干馏
难度: 简单查看答案及解析
-
实验操作的规范是实验的基本要求。下列实验操作正确的是

A. 闻气体气味 B. 点燃酒精灯 C. 过滤 D. 移开蒸发皿
难度: 中等查看答案及解析
-
完成下列实验所选择的装置或仪器都正确的是( )
A
B
C
D
实验
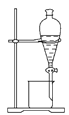
分离植物油和氯化钠溶液
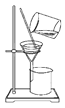
除去氯化钠晶体中混有的氯化钾晶体
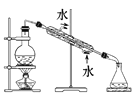
分离CCl4中的Br2
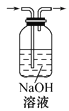
除去CO2气体中的HCl气体
装置
或仪器
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于纯净物、混合物、电解质、非电解质的组合正确的是
纯净物
混合物
电解质
非电解质
A
HCl
冰水混合物
纯碱
干冰
B
蒸馏水
氨水
火碱
二氧化硫
C
H2SO4
胆矾
纯碱
氨气
D
HNO3
加碘食盐
NaOH溶液
生石灰
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 氨气的摩尔质量是17g
B. NA个H2和NA个O2的质量比为1∶16
C. 标准状况下,22.4 L水中含有的分子数目为NA
D. 100 mL1mol/LMgCl2溶液中含有0.1mol Cl-
难度: 简单查看答案及解析
-
标准状况下,①6.72 L NH3、②1.204×1023 个H2S、③5.6 g CH4、④0.5 molHCl(标况下为气体),下列关系不正确的是
A. 体积大小:④>③>①>② B. 原子数目:③>①>④>②
C. 密度大小:④>②>①>③ D. 质量大小:④>③>②>①
难度: 中等查看答案及解析
-
下列操作中,完全正确的一组是( )
①用CCl4萃取碘水中的碘,萃取后分液操作的正确做法是从分液漏斗的下端放出I2的CCl4溶液;
②给盛有液体的体积超过1/3容积的试管加热;
③把鼻孔靠近容器口去闻气体的气味;
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管;
⑤取用放在细口瓶的液体时,取下瓶塞倒立放在桌面上,倾倒液体时,瓶上的标签对着地面;
⑥实验室制备蒸馏水的过程中,冷凝管中的冷凝水是上进下出;
⑦用坩埚钳夹取加热后的蒸发皿;
⑧将滴管垂直伸进试管内滴加液体;
⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中;
⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热。
A. ①④⑤⑦⑧⑩ B. ①④⑤⑦⑩ C. ①④⑦⑩ D. ④⑤⑦⑧⑩
难度: 中等查看答案及解析
-
将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于稀释后的溶液叙述不正确的是( )
A. 浓度为0.03 mol·L-1 B. 从中取出10 mL溶液,其浓度为0.03 mol·L-1
C. 含NaOH 0.6 g D. 从中取出10 mL溶液,含NaOH 0.015 mol
难度: 中等查看答案及解析
-
某溶液中只含有K+、Fe3+、NO3-,已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO3-的个数比为
A. 1︰2 B. 1︰4
C. 3︰4 D. 3︰2
难度: 简单查看答案及解析
-
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替Cl2来进行自来水消毒。我国最近成功研制出制取ClO2的新方法,其反应的微观过程如下所示:

下列有关该反应的叙述中正确的是( )
A. 该反应是复分解反应
B. 该反应的化学方程式为Cl2+2NaClO2====2ClO2+2NaCl
C. 反应中Cl2既是氧化剂,又是还原剂
D. NaClO2和ClO2中Cl的化合价相同
难度: 中等查看答案及解析
-
下列说法正确的是
A.向某溶液中加入Ba(NO3)2溶液后产生白色沉淀,则原溶液中一定含有SO42-
B.向某稀溶液中加入Ba(NO3)2溶液后无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明一定是氯化物的溶液
C.将盛满H2的小试管管口向上靠近酒精灯火焰检验H2的纯度
D.将燃着的木条靠近导管口,木条熄灭,说明有CO2生成
难度: 中等查看答案及解析
 无明显现象
无明显现象 无明显现象。则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。
无明显现象。则加入的试剂A为_______,B为_______,该现象证明样品中不含有____。