-
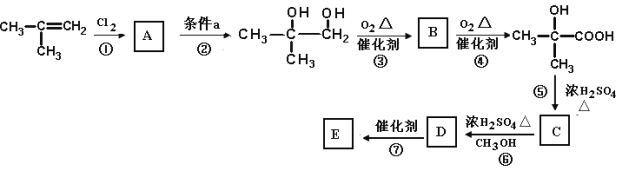
2017年,我国科学家实现了二氧化碳高稳定性加氢合成甲醇(CH3OH),在二氧化碳的碳资源化利用方面取得突破性进展。甲醇属于
A. 单质 B. 氧化物 C. 无机物 D. 有机物
难度: 简单查看答案及解析
-
下列操作会使H2O的电离平衡向正方向移动,且溶液呈酸性的是( )
A. 将纯水加热到95 ℃时,pH<7 B. 向水中加少量NaHSO4
C. 向水中加少量Na2CO3 D. 向水中加少量FeCl3
难度: 中等查看答案及解析
-
PH相同的下列溶液,溶质浓度最大的是( )
A. H3PO4 B. HCN C. HI D. H2SO4
难度: 中等查看答案及解析
-
向饱和石灰水中投入0.56g氧化钙,并恢复到原来的温度,下列说法正确的是( )
A. 溶液的pH增大 B. 溶液中c(Ca2+)不变
C. OH-数目不变 D. 析出的Ca(OH)2质量为0.74g
难度: 中等查看答案及解析
-
与纯水的电离相似,液氨中也存在着微弱的电离:2NH3⇌NH4++NH2﹣,据此判断以下叙述中不正确的是( )
A. 液氨中含有NH3、NH4+、NH2﹣微粒
B. 其他条件不变,若增加液氨的量,电离平衡将正向移动
C. 只要不加入其他物质,液氨中c(NH4+)=c(NH2﹣)
D. 一定温度下液氨中c(NH4+)• c(NH2﹣)是一个常数
难度: 中等查看答案及解析
-
在1L的容器中,用纯净的CaCO3与100mL稀盐酸反应制取CO2,反应生成CO2的体积随时间的变化关系如图所示(CO2的体积已折算为标准状况下的体积)。下列分析正确的是( )
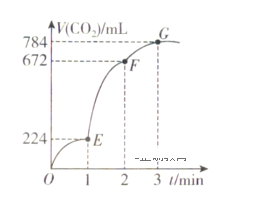
A. OE段表示的平均反应速率最快
B. F点收集到的C02的量最多
C. EF段,用盐酸表示该反应的平均反应速率为0.04mol·L-1·min-1
D. OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
难度: 中等查看答案及解析
-
某温度下,某容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g)
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
A.升高温度 B.加入催化剂
C.再加入n molCO和n molH2O D.再加入2n molCO2和2n molH2
难度: 困难查看答案及解析
-
下列物质中,酸性最强的是( )
A. 乙醇 B. 碳酸 C. 苯酚 D. 乙酸
难度: 简单查看答案及解析
-
下列物质分离提纯的方法不正确的是

A. 提纯含杂质的工业酒精选择装置③
B. 提纯含杂质的粗苯甲酸选择装置①②
C. 从溴水中提纯溴选择装置④
D. 苯中混有少量苯酚选择装置④
难度: 简单查看答案及解析
-
下列装置或操作正确且能达到实验目的的是
A. 读取滴定管读数
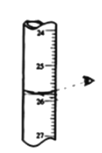 B. 排除滴定管内的气泡
B. 排除滴定管内的气泡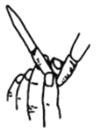 C. 酸碱中和滴定
C. 酸碱中和滴定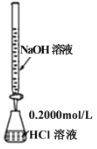 D. 中和热的测定
D. 中和热的测定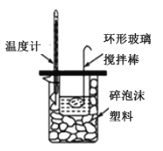
难度: 中等查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
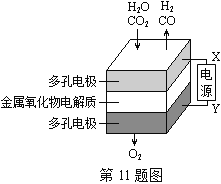
A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
难度: 中等查看答案及解析
-
取20 mL pH=3的CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
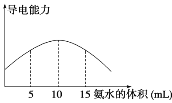
A. 0.5% B. 1.0% C. 0.1% D. 1.5%
难度: 困难查看答案及解析
-
可逆反应2NO2(g)
N2O4(g) △H<0。在密闭容器中进行,当达到平衡时,欲通过改变条件,达到新平衡后使气体颜色加深,应采取的措施是
A. 增大容器体积
B. 温度压强不变,充入N2O4(g)
C. 温度体积不变,充入NO2(g)
D. 容器容积不变,降低温度
难度: 中等查看答案及解析
-
下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. H2、I2、HI平衡混合气加压后颜色变深
C. 装有NO2的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析