-
化学与生活密切相关。下列说法错误的是
A. 用灼烧的方法可以区分蚕丝和人造纤维
B. 食用油反复加热会产生稠环芳香烃等有害物质
C. 福尔马林可用来浸制标本,因其可使蛋白质变性
D. 医用消毒酒精中乙醇的浓度为95%
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 28g 乙烯和丙烯混合物中的极性键数目为4NA
B. 32g Cu和32g S 充分反应,转移电子数为NA
C. 精炼铜时,若阳极失去0.1 NA 个电子,则阴极增重3.2g
D. 等物质的量的钠分别在足量的氧气和氯气中燃烧,转移电子数相等
难度: 中等查看答案及解析
-
下列实验操作不能达到实验目的的是
选项
实验目的
实验操作
A
除去蛋白质溶液中混有的(NH4)2SO4
将混合物装入半透膜袋,并放入流动的蒸馏水中
B
除去Mg 粉中混有的Al 粉
加入足量的NaOH 溶液,过滤、洗涤、干燥
C
用CCl4 萃取碘水中的I2
先从分液漏斗下口放出有机层,再从上口倒出水层
D
检验溶液中存在SO42‾
向未知溶液中加入盐酸酸化的BaCl2溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最高化合价与最低化合价的代数和为2,X的最简单氢化物在常温下为液体,Y的原子半径在同周期金属元素中最小,Z与X同主族。下列说法正确的是
A. W、X、Y属于同一周期元素
B. 四种元素中W的简单离子半径最大
C. X的最简单氢化物的热稳定性比Z的强
D. Y、Z形成的化合物溶解于水形成其水溶液
难度: 中等查看答案及解析
-
向21.6 g 铁粉和铜粉的混合物中加入1L 1 mol/L 硝酸溶液,充分反应,放出NO气体且金属有剩余。则反应后溶液中c(NO3‾) 可能为
A. 0.45 mol/L B. 0.6 mol/L C. 0.75 mol/L D. 0.9 mol/L
难度: 困难查看答案及解析
-
某化学兴趣小组为探究草酸分解的产物,设计的实验装置如图所示,下列说法正确的是
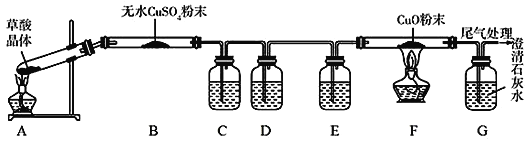
A. 实验开始时,先点燃A装置处的酒精灯,后点燃F装置处的酒精灯
B. B 装置中的现象为蓝色粉末变白,说明分解产物中有水生成
C. G装置中澄清石灰水变浑浊,说明分解产物中有CO生成
D. C、D、E装置中分别盛放澄清石灰水、浓硫酸、氢氧化钠溶液
难度: 困难查看答案及解析
-
下列反应的离子方程式正确的是
A. 氯气通入冷的氢氧化钠溶液中:Cl2 + 2OH‾ = Cl‾ + ClO‾ + H2O
B. Fe与少量稀硝酸的反应:Fe + 4H+ + NO3‾ = Fe3+ + NO↑+ 2H2O
C. 碳酸钡溶于醋酸:BaCO3 + 2H+ = Ba2+ + H2O + CO2↑
D. 用石墨电极电解MgCl2 溶液:2Cl‾ + 2H+
Cl2↑+ H2↑
难度: 中等查看答案及解析


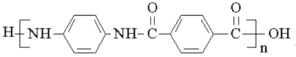 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: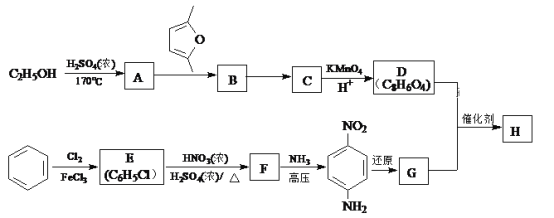
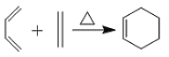 。
。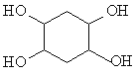 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______________________。
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______________________。