-
下列关于钠和过氧化钠与水反应的说法不正确的是( )
①将小块钠投入滴有石蕊溶液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③过氧化钠投入到水中会有大量氢气产生
④过氧化钠投入到滴有酚酞溶液的水中,烧杯中的水变红
A. 仅①② B. 仅②③ C. 仅②③④ D. ①②③④
难度: 中等查看答案及解析
-
下列分散系属于胶体的是( )
A. 石灰水 B. 豆浆 C. 泥水 D. 蔗糖水
难度: 简单查看答案及解析
-
依据阿伏加德罗定律,下列叙述中正确的是( )
A. 同温同压下,两种气体的体积之比等于摩尔质量之比
B. 同温同压下,两种气体的质量之比等于物质的量之比
C. 同温同压下,两种气体的物质的量之比等于密度之比
D. 同温同压下,两种气体的摩尔质量之比等于密度之比
难度: 中等查看答案及解析
-
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10—9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是 ( )
A. 在水中所形成的分散系属悬浊液
B. “钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 分子直径比Na+小
D. 在水中形成的分散系能产生丁达尔效应
难度: 简单查看答案及解析
-
下列现象或应用中,不能用胶体的知识解释的是( )
A. 在饱和氯化铁溶液中逐滴加入氢氧化钠溶液,产生红褐色沉淀
B. 用微波手术刀进行外科手术,可使开刀处的血液凝固而减少失血
C. 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱
D. 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
难度: 简单查看答案及解析
-
单质X和单质Y反应生成X3+和Y2-,现有下列叙述:①X被氧化,②X是氧化剂,③X3+是氧化产物,④X具有氧化性,⑤Y2-是还原产物,⑥X3+具有氧化性。其中正确的是( )
A. ①④⑤⑥ B. ②③④⑤ C. ①③⑤⑥ D. ①②④⑥
难度: 简单查看答案及解析
-
在反应3NO2+H2O===2HNO3+NO中,氧化剂和还原剂的物质的量之比为( )
A. 3∶1 B. 1∶3 C. 1∶2 D. 2∶1
难度: 中等查看答案及解析
-
下列物质在相应条件下能发生电离而导电的是( )
A. 液态氯化氢 B. 熔融氯化钠
C. 固体氢氧化钾 D. 高温熔化后的单质铁
难度: 简单查看答案及解析
-
下列关于氯水的叙述,正确的是( )
A. 新制氯水中只含Cl2和H2O分子
B. 新制氯水可使蓝色石蕊试纸先变红后褪色
C. 光照新制氯水有气泡逸出,该气体是Cl2
D. 新制氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
难度: 中等查看答案及解析
-
下列物质的变化能产生自由移动离子的是( )
A. 氯化氢气体溶于水 B. 蔗糖溶于水
C. 冰醋酸固体受热熔化 D. 红磷单质受热熔化
难度: 简单查看答案及解析
-
同温同压下,等质量的氧气和二氧化碳相比较,下列叙述正确的是( )
A. 质子数之比为1∶1 B. 密度比为11∶8
C. 物质的量之比为8∶11 D. 原子个数比1∶1
难度: 简单查看答案及解析
-
下列有关氯气的叙述中正确的是 ( )
A. 氯气在常温下能与铁反应,故不能用钢罐存放液氯
B. 液氯和氯水不是同一物质
C. 点燃氢气和氯气的混合气体可以制取氯化氢
D. 用氯气对生活用水进行消毒的原因是氯气能杀灭细菌
难度: 简单查看答案及解析
-
下列实验过程中没有气体产生的是( )
A.
 B.
B.  C.
C.  D.
D. 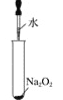
难度: 简单查看答案及解析
-
把铁片放入下列溶液中,铁片溶解且溶液质量减小,没有气体生成,此溶液是( )
A. FeSO4 B. H2SO4 C. Fe2(SO4)3 D. CuSO4
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 氯化钠水溶液在电流的作用下电离出Na+和Cl−
B. 硫酸钡难溶于水,但硫酸钡属于电解质
C. 二氧化碳溶于水能部分电离,故二氧化碳属于电解质
D. 硫酸钠在水中的电离方程式可表示为Na2SO4===2Na++S6++4O2−
难度: 简单查看答案及解析
-
下列各组都为两种化合物溶于水时电离出的离子:①Na+、OH-、SO42—,②H+、Cl-、SO42—,③Na+、K+、OH-,④Na+、K+、NO3—,其中按照仅由酸、碱、盐依次电离的是( )
A. ②③④ B. ②①④ C. ②③① D. ②①③
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 观察只是指用眼看 B. 观察只是指用耳听
C. 观察只是指用鼻嗅 D. 观察包括用手感觉
难度: 简单查看答案及解析
-
离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、HCO3—的摩尔电导率分别为0.60、1.98、0.45,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )




难度: 中等查看答案及解析
-
下列反应可以用同一离子方程式表示的是
A. HCl + Na2CO3;HCl + NaHCO3
B. NaOH + HCl;Ba(OH)2 + H2SO4
C. BaCl2 + H2SO4;Ba(OH)2 + Na2SO4
D. CaCO3 + HCl;Na2CO3 + H2SO4
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A. 任何条件下氯化氢气体的密度都小于二氧化氮
B. 2.3 g 钠与1.12 L 氯气反应后,生成5.85 g 氯化钠
C. 常温常压下,1 g氦气和1 g氧气的体积比为2∶1
D. 在同温同体积时,气体物质的物质的量越大,压强越大
难度: 简单查看答案及解析
-
氢氧化钾是我国古代纺织业常用于漂洗的洗涤剂。古代制取氢氧化钾的流程如下:

在上述流程中没有涉及的化学反应类型是
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
难度: 中等查看答案及解析
-
下列物质中既有氧化性又有还原性的是( )
A. NaCl B. Al2O3 C. N2O3 D. SiO2
难度: 简单查看答案及解析
-
下列各图中能较长时间看到氢氧化亚铁白色沉淀的是( )

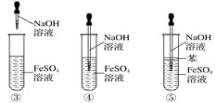
A. ①②③④⑤ B. ①②⑤ C. ①②③④ D. ②④⑤
难度: 简单查看答案及解析
-
常温下,在溶液中可发生如下反应:Ce4++Fe2+=Fe3++Ce3+,Sn2++2Fe3+=2Fe2++Sn4+。由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是( )
A. Sn2+、Fe2+、Ce3+ B. Fe2+、Ce3+、Sn2+
C. Fe2+、Sn2+、Ce3+ D. Ce3+、Fe2+、Sn2+
难度: 简单查看答案及解析
-
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是
A. 若无固体剩余,则溶液中一定有Fe3+
B. 若有固体存在,则溶液中一定有Fe2+
C. 若溶液中有Cu2+,则一定没有固体析出
D. 若溶液中有Fe2+,则一定有Cu析出
难度: 中等查看答案及解析
-
下列有关氯气性质的说法正确的是( )
A. 氯气通入含酚酞的氢氧化钾溶液中,溶液褪色,证明氯气具有漂白性
B. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
C. 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后呈红色
D. 氯气有毒,氯气还可用于消毒杀菌
难度: 简单查看答案及解析
-
实验室为了使用方便,通常将氯气溶解于水中形成氯水,或将其降温加压形成液氯来使用。下列有关这两种液体的实验描述都正确的是( )
A. 两种液体都可以使干燥的有色布条褪色
B. 两种液体都可以使干燥的蓝色石蕊试纸变红
C. 用这两种液体都可给自来水消毒
D. 分别向这两种液体中投入几颗金属锌粒均有气泡产生
难度: 简单查看答案及解析
-
某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
难度: 中等查看答案及解析
-
同温同压下,两种气体的体积相同,则两种气体( )
A. 所含的原子数一定相等 B. 密度一定相等
C. 质量一定相等 D. 所含的分子数一定相等
难度: 中等查看答案及解析
-
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
A. F2、K、SO2 B. Cl2、Al、S
C. NO2、Na、Br2 D. HNO3、HCl、Fe2+
难度: 简单查看答案及解析

