-
化学与生活、生产密切相关。下列说法正确的是
A. 使用大量肥料和农药来增加农作物的产量
B. 聚乳酸和聚氯乙烯常用一次性快餐盒的材料
C. 矿物油溅在衣服上可用热纯碱溶液去除
D. 补血剂硫酸亚铁片与维生素C同时服用效果更佳
难度: 中等查看答案及解析
-
三国时期曹植在《七步诗》中这样写到“煮豆持作羹,漉豉以为汁。萁在釜下燃,豆在釜中泣。……”,文中“漉”涉及的化学实验基本操作是
A. 过滤 B. 分液 C. 升华 D. 蒸馏
难度: 简单查看答案及解析
-
有机物m、n、P存在如下转化关系。下列说法正确的是

A. m、n不存在同分异构体,p存在多种同分异构体
B. m、n、p均能使酸性高锰酸钾溶液褪色
C. m、n、p中所有原子可能共面
D. 等质量的m、n、p,完全燃烧耗氧量不相等
难度: 中等查看答案及解析
-
下列根据实验现象得出的实验结论正确的是
选项
实验操作
实验现象
实验结论
A
向盛有KNO3和KOH混合液的试管中加入铝粉并加热,将湿润的红色石蕊试纸靠近试管口
试纸变为蓝色
NO3-被还原为NH3
B
将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液
溶液变成红色
Fe(NO3)2样品中一定含有Fe3+
C
向浓度均为0.1mol/L的Na2CO3和Na2S混合溶液中滴入少量AgNO3溶液
产生黑色沉淀
Ksp(Ag2S)>Ksp(Ag2CO3)
D
向KI溶液中加入少量苯,然后加入FeCl3溶液
有机层呈橙红色
还原性Fe2+>I-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
空气污染物NO通常用含Ce4+的溶液吸收,生成HNO2、NO3-,再利用电解法将上述吸收液中的HNO2转化为无毒物质,同时生成Ce4+,其原理如图所示。下列说法正确的是
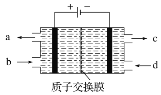
A. H+由右室进入左室
B. Ce4+从电解槽的c口流出,且可循环使用
C. 阴极的电极反应式:2HNO2+6H++6e-===N2↑+4H2O
D. 若用甲烷燃料电池作为电源,当消耗标准状况下33.6 L甲烷时,理论上可转化2mol HNO2
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E 是三元化合物,物质之间存在如下图所示的关系。下列说法不正确的是
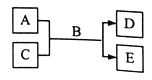
A. 离子半径大小关系:Y>Z>X>W
B. YX2遇到蓝色石蕊试液先变红后褪色
C. 简单阴离子的还原性:Y>Z
D. Y与Z属于同一周期,与X属于同一主族
难度: 中等查看答案及解析
-
常温下,某酸H3A水溶液中含A的各种粒子的分布分数(平衡时某种粒子的浓度占各粒子浓度之和的分数)与pH的关系图如下所示,下列说法正确的是
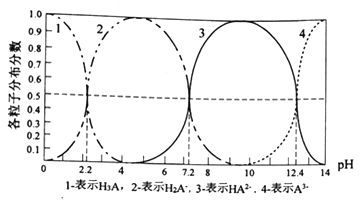
A. NaH2A水溶液呈碱性
B. H3A溶液中存在:c(H+)=c(OH-)+c(H2A-)+1/2c(HA2-)+1/3c(A3-)
C. 向H3A溶液中加入一定量的NaOH溶液至pH=5时,c(HA2-)/c(H3A)=100.6
D. 向H3A溶液中加入氨水使pH从5→9发生的主要离子反应是:H2A-+OH-
HA2-+H2O
难度: 困难查看答案及解析
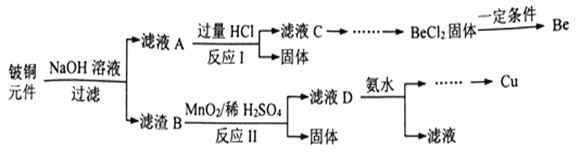
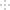

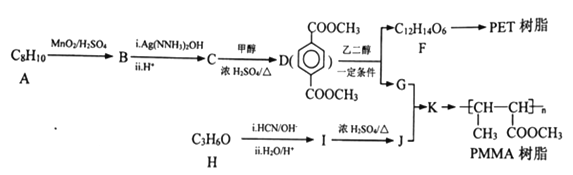
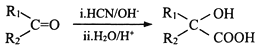 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)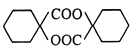 的合成路线(其他试剂任选)_______。
的合成路线(其他试剂任选)_______。