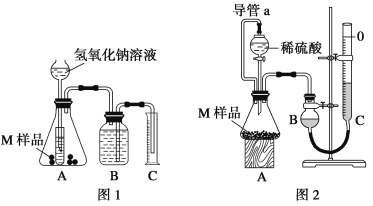
-
现有下列三个氧化还原反应:① 2B- + Z2 = B2+2Z-② 2A2+ + B2 = 2A3+ + 2B-③2XO4- + 10Z - + 16H+ = 2X2+ + 5Z2 + 8H2O,根据上述反应,判断下列结论中正确的是( )
A. 要除去含有A2+、Z -、B-混合溶液中的A2+,而不氧化Z –和B-,应加入B2
B. 氧化性强弱顺序为:XO4->Z2>A3+>B2
C. X2+是 XO4-的氧化产物, B2是B-的还原产物
D. 在溶液中不可能发生反应:XO4-+5A2++8H+ =X2++5A3++4H2O
难度: 中等查看答案及解析
-
2018年10月3日瑞典皇家科学院宣布,将授予美国科学家弗朗西斯·阿诺德(Frances H. Arnold)、美国科学家乔治·史密斯(George P. Smith)及英国科学家格雷戈里· 温特尔(Sir Gregory P. Winter)三位科学家2018诺贝尔化学奖,以表彰他们在酶的定向演化以及用于多肽和抗体的噬菌体展示技术方面取得的成果。在物质的分类上,酶属于
A. 单质 B. 无机物 C. 有机物 D. 氧化物
难度: 简单查看答案及解析
-
已知由AgNO3溶液和稍过量的KI溶液制得的AgI胶体,当它跟Fe(OH)3胶体相混合时,能析出AgI和Fe(OH)3的混合沉淀,由此可知
A. 该AgI胶粒带正电荷 B. 该AgI胶体带负电荷
C. 该AgI胶体进行电泳时,胶粒向阳极移动 D. 该AgI胶体是电解质
难度: 简单查看答案及解析
-
中国不少古诗词清晰的描绘了当时人民的生活和社会的发展,如刘禹锡的浪淘沙“日照澄州江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识正确的是
A. “沙中浪底来”指的是金的氧化物
B. 淘金原理与化学上的萃取一致
C. 雾的分散质粒子直径范围是10-9~10-7cm
D. 由沙子(主要成分二氧化硅)到计算机芯片(硅)发生了还原反应
难度: 简单查看答案及解析
-
下列关于金属的说法正确的是
A. 铝箔在空气中受热可以熔化且会发生剧烈燃烧
B. Na在空气中燃烧,发出黄色火焰,生成白色固体
C. 铁与水蒸气反应的产物是黑色的Fe2O3
D. 铝制餐具不能用来盛装酸、碱、咸的食物
难度: 简单查看答案及解析
-
下列实验操作中错误的是
A. 萃取操作振荡时,要不时打开分液漏斗的活塞放气
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 蒸发时,蒸发皿必须要垫石棉网加热
D. 容量瓶、分液漏斗在使用前都要检查是否漏液
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol 铁和高温水蒸气完全反应转移的电子数为3NA
B. 常温常压下,1mol 氦气含有的原子数为NA
C. 标准状况下,11. 2 L 乙醇含有的分子数目为0. 5NA
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
难度: 简单查看答案及解析
-
在某无色透明的酸性溶液中,能大量共存的离子组是
A. NH4+、NO3-、Al3+、Cl- B. Na+、SiO32- 、K+、NO3-
C. MnO4-、K+、SO42-、Na+ D. K+、SO42-、HCO3-、Na+
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 实验室把少量的钠保存在煤油中
B. 金属钠着火后,用干燥的沙土来灭火
C. 实验后剩余的钠,需要放回原试剂瓶
D. 浓硫酸不慎溅到皮肤上,应该立即用大量水冲洗,然后涂上稀NaOH溶液
难度: 简单查看答案及解析
-
下列实验中,所选装置或实验设计合理的是
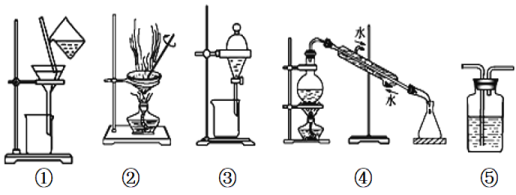
A. 用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 用图④所示装置可以分离乙醇水溶液
D. 图⑤所示装置中盛有饱和Na2CO3溶液除去CO2中含有的少量HCl
难度: 简单查看答案及解析
-
将一小块金属钠投入下列溶液中,既能产生气体又会出现白色沉淀的是
A. 稀硫酸 B. 碳酸氢钙溶液 C. 硫酸铜溶液 D. 氯化铵溶液
难度: 简单查看答案及解析
-
下列关于氧化还原反应的说法正确的是
①有一种元素被氧化肯定有另一种元素被还原
②阳离子只有氧化性,阴离子只有还原性
③在K、Fe2+、S2-、Na+中只有1种粒子不具有还原性
④由X变为X2+的反应是氧化反应
⑤金属单质在反应中只作还原剂
⑥非金属单质在反应中只作氧化剂
⑦含最高价元素的化合物,一定具有强氧化性
A. ③④⑤ B. ④⑤⑦ C. ①③④⑤⑥ D. ②③④⑤⑥⑦
难度: 简单查看答案及解析
-
下列两种气体的原子数一定相等的是
A. 质量相等、密度不等的N2和C2H4
B. 等体积、等密度的CO和N2
C. 等温、等体积的O2和Cl2
D. 等压、等体积的NH3和CO2
难度: 中等查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是
A. KClO3在反应中得到电子 B. ClO2是还原产物
C. H2C2O4发生氧化反应 D. 1 molKClO3参加反应有2mol电子转移
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B. 澄清石灰水与少量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-
CaCO3↓+ H2O
C. 向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O
Fe(OH)3↓+3H+
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
难度: 简单查看答案及解析
-
甲、乙两烧杯中各盛有100 mL 1.5 mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入2.7 g的铝粉,反应结束后甲、乙两烧杯中生成气体在相同条件下的体积比是
A. 1∶1 B. 1∶2 C. 2∶1 D. 3∶2
难度: 简单查看答案及解析
-
某同学将 0.1mol/L 的 K2SO4 溶液 V 1 L 与 0 . 2 mo l / L 的 Al2(SO4)3溶液 V 2 L 混合,再加入 V 3 L 蒸馏水,假定溶液 总体积 V 总 =V1 +V 2 +V 3 .并测得混合液中三种离子物质的量浓度 分别为:K+:0 .1 mo l /L ,Al3+:0 .1 mo l /L,SO42-:0 . 2 mo l / L , 则 下 列 判 断 正 确 的 是( )
A. 一定是 2L K2SO4 溶液和 1L Al2(SO4)3溶液混合,再加 1L 蒸馏水
B. 混合液中K+浓度与Al3+浓度数值之和大于SO42-浓度数值
C. 三种液体体积比为 V1:V2:V3=2:1:1
D. 混合液中 K2SO4 物质的量等于 Al2(SO4)3物质的量的一半
难度: 困难查看答案及解析
-
0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(标准状况)时立即停止,则这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)
A.
 B.
B. 
C.
 D.
D. 
难度: 中等查看答案及解析