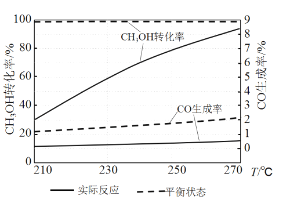
-
下列表述正确的是
A. 杜康用高粱酿酒的原理是通过蒸馏法将高粱中的乙醇分离出来
B. 超导材料K3C60在熔融状态下能导电,说明K3C60是电解质
C. 推广使用煤液化技术可以减少温室气体二氧化碳的排放
D. 用植物秸秆和甘蔗渣等原料造纸并将废水通过高压水井压到地下,可节约生产成本
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论不正确的是
选项
实验操作和现象
结论
A
向浓度均为0.1mol/L的MgCl2、CuC12混合溶液中逐滴加入氨水,先出现蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
B
向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀
X不一定具有氧化性
C
某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成
不能说明该溶液中一定含有SO42-
D
加热盛有(NH4)2CO3固体的试管,并在试管口放置湿润的红色石蕊试纸,试纸变蓝
(NH4)2CO3显碱性
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径: Y>Z>R>X
难度: 困难查看答案及解析
-
网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构。下列有关辛酸的叙述正确的是
A. 辛酸的羧酸类同分异构体中,含有三个“-CH3”结构,且存在乙基支链的共有7种
B. 辛酸的同分异构体(CH3)3CCH(CH3)CH2COOH的名称为2,2,3一三甲基戊酸
C. 正辛酸常温下呈液态而软脂酸常温下呈固态,故二者不符合同一通式
D. 辛酸的同分异构体中能水解生成相对分子质量为74的有机物的共有8种
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 白磷(P4)为正四面体结构,1mol P4与1mol金刚石所含共价键数目之比为1:1
B. 1mol乙酸与足量的C2H518OH 充分发生酯化反应可生成CH3CO18OC2H5分子NA个
C. 9g13CO2与N217O的混合物中所含中子数为4.6NA
D. 浓度均为lmol/L的醋酸和醋酸钠溶液等体积混合,溶液中CH3COOH 和CH3COO-的总数为2NA
难度: 中等查看答案及解析
-
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图一所示,工作原理为Fe3++Cr2+
Fe2++Cr3+。图二为利用H2S废气资源回收能量并得到单质硫的质子膜燃料电池。下列说法一定正确的是
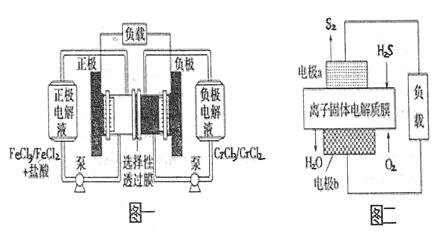
A. 图一电池放电时,C1-从负极穿过选择性透过膜移向正极
B. 图一电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol/L
C. 用图二电池给图一装置充电时,图二中电极a接图一的正极
D. 用图二电池给图一装置充电时,每生成1molS2(s),图一装置中就有4molCr3+被还原
难度: 困难查看答案及解析
-
常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数δ(X)随-lg(OH-) 变化的关系如图所示。下列叙述错误的是
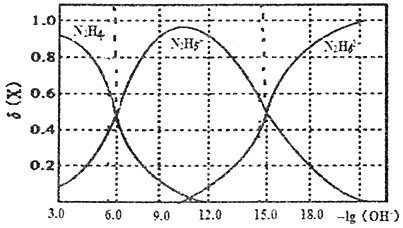
下列叙述错误的是
A. Kb1(N2H4)=10-6
B. 反应N2H62++N2H4=2N2H5+的PK=9.0 (已知:pK=-1gK)
C. N2H5C1溶液中c(H+)>c(OH-)
D. N2H5C1溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+(H+)
难度: 困难查看答案及解析
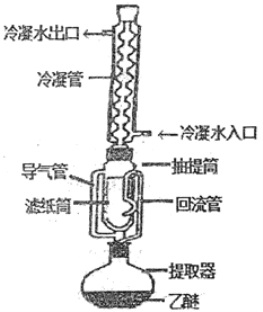
 b.直形冷凝管
b.直形冷凝管

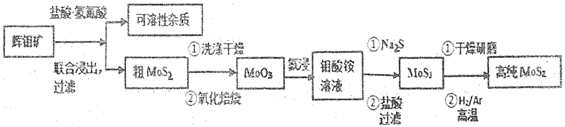
 2UF4·NH4F+3NH3↑+ 4H2O ↑
2UF4·NH4F+3NH3↑+ 4H2O ↑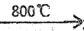 3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O ↑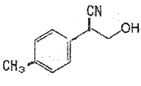 中与CO32- 的碳原子杂化类型相同和不同的碳原子的个数比为______。
中与CO32- 的碳原子杂化类型相同和不同的碳原子的个数比为______。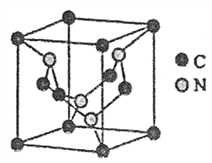
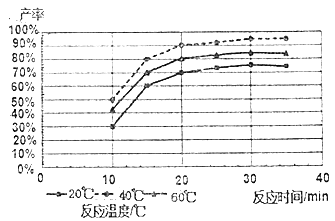
 ]是一种医药中间体,它的一种合成路线如下:
]是一种医药中间体,它的一种合成路线如下: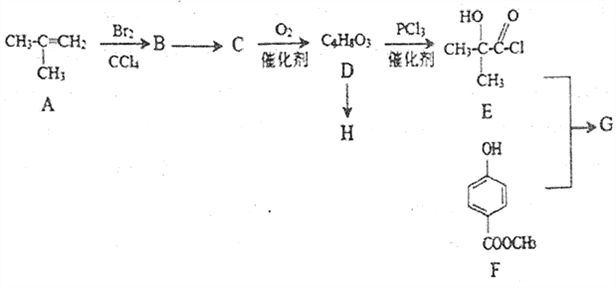
 RCOCl
RCOCl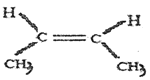 名称是_______。
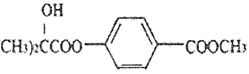
名称是_______。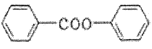 )的合成路线(其它试剂任选)。___________
)的合成路线(其它试剂任选)。___________