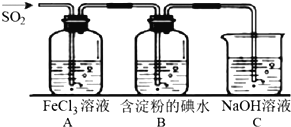
-
化学与环境密切相关,下列有关说法正确的是
A. CO2和NO2都会导致酸雨的形成
B. 大气中的PM 2.5会导致雾霾的形成
C. NO2和SO2都会导致光化学烟雾的形成
D. 大气中SO2含量的增加会导致温室效应加剧
难度: 简单查看答案及解析
-
《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是
A. Ca(OH)2 B. CaCO3 C. K2CO3 D. Na2SO4
难度: 简单查看答案及解析
-
下列说法错误的是
A. 浓硝酸通常保存在无色玻璃试剂瓶中
B. NH4Cl溶液中加入镁条会产生气泡
C. 单质硅是将太阳能转变成电能的常用材料
D. 钢铁的析氢腐蚀和吸氧腐蚀的负极反应相同
难度: 中等查看答案及解析
-
下列说法正确的是
A. O2与O3互称同位素
B. 铅蓄电池充电时负极连接外电源正极
C. 高纯度硅常用于制作现代通讯的光导纤维
D. 常用丁达尔效应鉴别溶液和胶体
难度: 中等查看答案及解析
-
下列有关化学用语正确的是
A. 原子核内有18个中子的氯原子:3517Cl B. S原子的结构示意图:
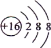
C. 胆矾的化学式:CuSO4 D. 次氯酸的结构式:H—Cl— O
难度: 简单查看答案及解析
-
两种盐的固体混合物:①加热时有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的固体混合物是
A. BaCl2和(NH4)2SO4 B. AlCl3和NaHCO3
C. AgNO3和NH4Cl D. KCl和K2CO3
难度: 中等查看答案及解析
-
下列说法错误的是
A. 铝与烧碱溶液反应铝作还原剂 B. 在硫酸铁溶液中滴加硫氰化钾溶液,溶液变红
C. 可用 Al2O3 制成的坩埚熔融烧碱 D. 明矾溶于水能形成胶体,可用其净化生活用水
难度: 中等查看答案及解析
-
下列说法正确的是
A. 可用硝酸加热除去试管内壁附着的银镜
B. 酸碱中和滴定实验中,锥形瓶需用所盛溶液润洗
C. 常用硫酸铝溶液与过量氢氧化钠溶液制取氢氧化铝
D. 提纯混有少量硝酸钾的氯化钠 ,应采用在较高温度下制得浓溶液再再冷却结晶、过滤、干燥的方法
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 吸热反应一定不能自发进行
B. 由C(s,石墨)=C(s,金刚石)△H=+1.9kJ•mol-1,可知金刚石比石墨稳定
C. S(s)+O2(g)=SO2(g) △H1,S(g)+O2(g)=SO2( g) △H2,则△H1>△H2
D. 已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ•mol-1,则0.5molH2SO4 与0.5molBa(OH)2反应一定放出57.3kJ热量
难度: 中等查看答案及解析
-
下列除杂方法正确的是
A. 用浓硫酸除去H2S中的H2O B. 用饱和碳酸氢钠除去Cl2中的HCl
C. 用铁粉除去FeCl3溶液中的CuCl2 D. 用灼热的CuO除去CO2中的CO
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定不能大量共存的是
A. 在能使Al 产生氢气的溶液中:H+、Na+、 C1-、Cu2+
B. 在 Kw/c(OH-)=1 mol·L-1 的溶液中:Na +、NH4+、I- 、SO42-
C. 在 0.1 mol·L-1NaHSO4 溶液中:K+、Fe2+、C1-、NO3-
D. 在能使甲基橙显黄色的溶液中 :Na+、Ba2+ 、Br-、C1-
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 向碳酸氢钠溶液中滴入少量氢氧化钙溶液:HCO3−+O H–= CO32−+ H2O
B. 向 FeBr2 溶液中通入足量氯气:2Fe2++4Br−+3Cl2=2Fe3++2Br2+6Cl−
C. 向稀硝酸中加入铜片:Cu+4H+ +2NO3–= Cu 2++2NO2↑+2 H2O
D. 用醋酸除去水垢:2H++CaCO3 =Ca2++ CO2↑ + H2O
难度: 中等查看答案及解析
-
实验室用 H 2 还原 WO3 制备金属 W 的装置如下图所示(Zn 粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法错误的是
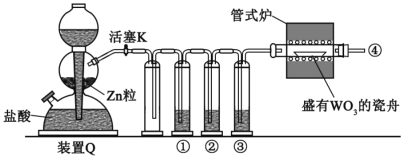
A. 反应开始时,先加热管式炉,再打开活塞 K
B. 往盐酸中加入少量 CuCl2,可加快产生 H2 的速率
C. ①、②、③中依次盛装 KMnO4 溶液、焦性没食子酸溶液、浓 H2SO4
D. 装置 Q(启普发生器)也可用于石灰石与盐酸反应制二氧化碳
难度: 中等查看答案及解析
-
下列说法正确的是
A. 含 1molFeCl3 的溶液充分水解产生胶体粒子数为 1NA
B. 标准状况下,22.4LSO3 所含的分子数为1NA
C. 1.0L0.1 mol·L−1Na2CO3 溶液所含的阴离子数大于 0.1 NA
D. 一定条件下,2.3gNa 完全与O2反应生成 3.6g 产物时失去的电子数为 0.2NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 最外层有2个电子的原子都是金属原子
B. 同一周期元素的原子,半径越小越容易失去电子
C. 同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
D. 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
难度: 中等查看答案及解析
-
25℃,a mol·L−1 HCl与b mol·L−1 一元碱MOH等体积混合后,pH为7,则下列关系一定正确的是
A. a≤b B. a≥b
C. c (Cl−)>c(M+) D. c (Cl−)< c(M+)
难度: 中等查看答案及解析
-
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A. M B. M2+ C. M3+ D. MO2+
难度: 中等查看答案及解析
-
电浮选凝聚法是工业上采用的一种污水处理方法,即保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3胶体,Fe(OH)3胶体具有吸附作用,可吸附水中的污物而使其沉淀下来,起到净水的作用,其原理如图所示。下列说法正确的是
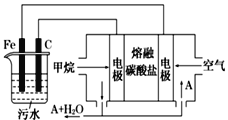
A. 石墨电极上发生氧化反应
B. 根据图示,物质A为CO2
C. 为增强污水的导电能力,可向污水中加入适量乙醇
D. 甲烷燃料电池中CO32-向空气一极移动
难度: 困难查看答案及解析
-
下列叙述 I 和叙述 II 均正确且因果关系也一定正确的是
选项
叙述 I
叙述 II
A
用pH计分别 测定SO2 和CO2溶于水形成溶液的 p H,前者pH小
说明H2SO 3 酸性强于H2CO3
B
SiO2是酸性氧化物
SiO2 不与任何酸溶液反应
C
Sn 2+容易水解且在空气中能氧化为Sn 4+
配制SnCl2溶液时,先将SnCl2溶于适量稀盐酸中,再用蒸馏水稀释,保存时再在试剂瓶中加入入少量锡粒
D
浓硫酸具有强氧化性
浓硫酸能使滤纸变黑
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将 10mL0.2 mol·L-1 氯化铵溶液跟 25 mL0.05 mol·L-1 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序为
A. c(Cl-) >c(OH-) > c(NH4+)>c( Ba2+)
B. c(Cl-) >c(Ba2+) >c(OH-)>c(NH4+)
C. c(Ba2+) >c(Cl-) >c(OH-) >c(NH4+)
D. c(Cl-) >c(Ba2+)>c (NH4+) >c(OH-)
难度: 困难查看答案及解析
-
一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生反应 2CH3OH(g)
CH3OCH3( g)+H2O(g)
容器
温度(℃)
起始物质的量(mmol)
平衡物质的量 (mol)
编号
CH3OH(g)
CH3OCH3(g)
H2O(g)
I
387
0.10
0.040
0.040
Ⅱ
387
0.20
Ⅲ
207
0.20
0.090
0.090
则下列说法正确的是
A. 该反应的∆H﹥0
B. 达到平衡时,CH3OH 体积分数容器Ⅱ中的比容器 I 中的大
C. 反应达到平衡所需时间容器Ⅱ比容器Ⅲ长
D. 207℃ 若向容器Ⅳ( 1.0L 恒容密闭)充入 CH3OH 0.1mol、CH3OCH3 0.15mol 和 H2O0.20mol, 则反应将向正反应方向进行
难度: 困难查看答案及解析