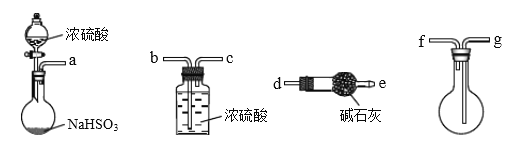
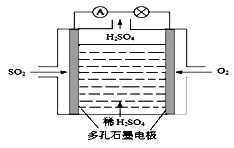
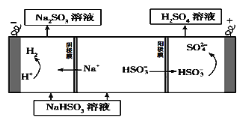
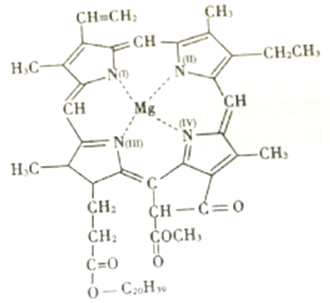
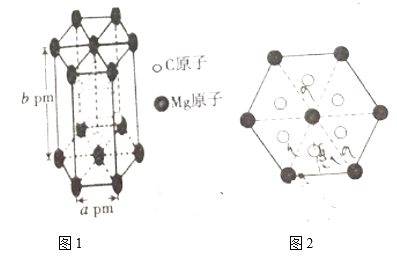
-
根据下列实验操作和现象,得出的结论不正确的是
选项
实验操作、现象
结论
A
向淀粉容液中滴入硫酸,加热一段时间后,滴入银氨溶液,水浴加热,无银镜现象出现。
淀粉未水解
B
取少量绿矾(FeSO4·7H2O)溶于稀硫酸溶液中,滴加KSCN溶液,溶液未变红色
绿矾未因氧化而变质
C
将适量Cl2通入NaBr溶液中,再加入CCl4,振荡;静置,下层液体呈橙红色。
Cl2的氧化性大于Br2
D
向含等物质的量浓度的Cu2+、Zn2+溶液中,滴加Na2S溶液,先生成黑色沉淀,静置,继续滴加Na2S溶液,又产生白色沉淀。
Ksp(CuS)sp(ZnS)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
NA为阿伏加德罗常数的值。下列叙述正确的是( )
A. 将2mol 二氧化硫和1mol 氧气通入密闭容器中,在一定条件下充分反应,转移电子数为4NA
B. 常温下,44g CO2中含有2NA个碳氧双键
C. 标准状况下,0.1mol Al3+含有的核外电子数为0.3NA
D. 室温下,1LpH=13的氢氧化钡溶液所含氢氧根离子数为0.2NA
难度: 中等查看答案及解析
-
《中华好诗词》不仅弘扬了中国传统文化,还蕴含着许多化学知识。下列诗词分析不正确的是( )
A. “南朝四百八十寺,多少楼台烟雨中”中的“烟雨”指雾
B. “春蚕到死丝方尽,蜡炬成灰泪始干”中的“蜡炬”的主要化学成分是烃类物质
C. “野火烧不尽,春风吹又生”中的“野火”是伴随氧化还原反应而产生的
D. “爆竹惊邻鬼,驱傩逐小儿”中所指的爆竹燃放过程化学能只转化为光能
难度: 中等查看答案及解析
-
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是
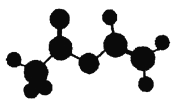
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物能发生水解反应,不能发生加聚反应
D. 该化合物的链状同分异构体中,能与NaHCO3反应放出CO2的只有3种
难度: 困难查看答案及解析
-
X、Y、Z、W是短周期主族元素,X原子最外层电子数是其内层电子数的3倍;Y的原子序数是其最外层电子数的6倍;Z的一种单质是自然界中最硬的物质;自然界中,W的单质多出现在火山口附近,且为淡黄色晶体。下列叙述不正确的是( )
A. 简单离子半径的大小:W>X > Y
B. Z的氢化物的沸点不一定比X 的低
C. W的最高价氧化物对应水化物的酸性在同周期中最强
D. Y的单质可通过电解熔融的氯化物冶炼
难度: 中等查看答案及解析
-
某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)
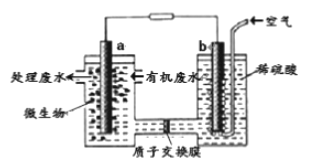
A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
难度: 中等查看答案及解析