-
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列说法正确的是( )
A. Cu2S既是氧化产物又是还原产物
B. 5molFeS2发生反应,有10mol电子转移
C. 产物中的SO42-离子有一部分是氧化产物
D. FeS2只作还原剂
难度: 困难查看答案及解析
-
向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列说法正确的是( )
A. Cu与Cu2O 的物质的量之比为1:2
B. 产生的NO的体积为4.48L
C. 硝酸的物质的量浓度为2.6mol/L
D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 简单查看答案及解析
-
化学与生产、生活、环境等社会实际密切相关。下列叙述正确的是
A. “滴水石穿、绳锯木断”不涉及化学变化
B. 明矾净水的原理和消毒液消毒的原理不相同
C. 氟利昂作制冷剂会加剧雾霾天气的形成
D. 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
难度: 简单查看答案及解析
-
设NA为阿伏加罗常数的值,下列说法正确的是
A. 常温常压下,22.4L CO2所含的原子数为3NA
B. 1mol Cl2与足量的Fe完全反应,转移的电子数为2NA
C. 0.5mol C2H2和C6H6的气态混合物中所含原子总数为2NA
D. 2L 1mol/L的盐酸中所含HCl分子数约为2NA
难度: 困难查看答案及解析
-
向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是
A. 氯气:K+、Na+、SiO32-、NO3-
B. 二氧化硫:Na+、NH4+、SO32-、Cl-
C. 硫化氢:H+、K+、MnO4-、SO42-
D. 氨气:K+、Na+、AlO2-、CO32-
难度: 中等查看答案及解析
-
下列说法正确的是
A. HClO中氯元素化合价比HClO4中氯元素化合价低,所以HClO4的氧化性强
B. 已知①Fe + Cu2+===Fe2++ Cu ②2Fe3++ Cu===2Fe2++ Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+
C. 已知还原性:B->C->D-,反应2C-+ D2===2D-+ C2和反应2C-+ B2===2B-+ C2都能发生
D. 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
难度: 困难查看答案及解析
-
下列反应先后顺序判断正确的是
A. 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入氯气:I-、Br-、Fe2+
B. 在含等物质的量的NaCl、NaBr的溶液中加入硝酸银溶液:Cl-、Br-
C. 在含等物质的量的Fe3+、Cu2+的溶液中加入铁粉:Cu2+、Fe3+
D. 在含等物质的量的H+、Al3+ 的溶液中,逐滴加入NaOH溶液:H+、Al3+、Al(OH)3
难度: 困难查看答案及解析
-
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去)。下列说法错误的是

A. 若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应
B. 常温下,若丙为无色气体,戊为红棕色气体,则甲、乙可能是铜和稀硝酸
C. 若甲为硫磺燃烧产物,丁为水,则戊不可用于干燥甲
D. 若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加,X与Y形成的化合物能与水反应生成酸且X、Y同主族,两元素核电荷数之和与W、Z的原子序数之和相等,则下列说法正确的是
A. Z元素的含氧酸一定是强酸 B. 原子半径:X>Z
C. 气态氢化物的热稳定性:W>X D. W、X与H形成化合物的水溶液可能呈碱性
难度: 困难查看答案及解析
-
下列混合溶液中,离子的浓度大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl-)=c(NH4+)>c(OH-)>c(H+)
B. 10 mL 0.5 mol/LCH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
C. 10 mL 0.1 mol/L醋酸与5 mL 0.2 mol/LNaOH溶液混合:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D. 10 mL 0.1 mol/LNH4Cl溶液与5 mL 0.2 mol/LNaOH溶液混合:c(Na+)= c(Cl-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
醋酸溶液中存在电离平衡CH3COOH
H+ + CH3COO-,下列叙述正确的是

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-) + c(CH3COO-)
D. 0.10mol·L-1的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
难度: 困难查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果,下列图像描述正确的是
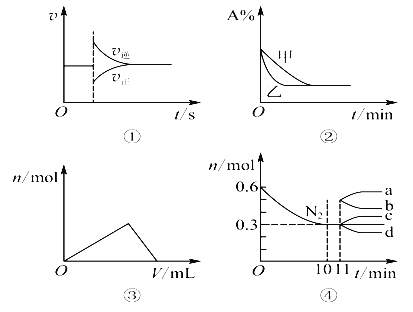
A. 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图②表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(g)的影响,且甲的压强大
C. 图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系
D. 图④表示在2 L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10 min内该反应的平均速率v(H2)=0.045 mol·L-1·min-1,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为d
难度: 困难查看答案及解析
-
下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应
平衡常数
温度
973K
1173K
① Fe(s) + CO2(g)
FeO(s) + CO(g) ΔH 1
K1
1.47
2.15
② Fe(s) + H2O(g)
FeO(s) + H2(g) ΔH 2
K2
2.38
1.67
③ CO(g) + H2O(g)
CO2(g) + H2(g) ΔH 3
K3
?
?
则下列说法正确的是
A. ΔH 1<0,ΔH 2>0
B. 反应①②③的反应热满足关系:ΔH 2-ΔH 1=ΔH 3
C. 反应①②③的平衡常数满足关系:K1·K2=K3
D. 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
难度: 简单查看答案及解析
-
已知:2Fe3+ + SO32-+ H2O
2Fe2+ + SO42-+ 2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是

A. G的指针指向B极
B. U中阳离子向A极移动
C. 一段时间后,化学反应达到平衡状态,导线中无电流通过
D. 一段时间后,B中溶液pH增大
难度: 困难查看答案及解析
-
如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3 +6H2O,
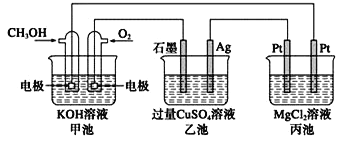
下列说法正确的是( )
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+8H+
C. 甲池中消耗280 mL(标况下)O2,此时丙池中理论上最多产生1.45 g固体
D. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使溶液恢复原浓度
难度: 中等查看答案及解析