-
下列说法不正确的是
A. 增加反应物的物质的量,反应速率不一定能加快
B. 可逆反应A(g)
B(g)+C(g),增大压强,正反应速率和逆反应速率都增大
C. 对达到平衡的一个放热的可逆反应,若降低温度正反应速率减小,逆反应速率增大
D. 参加反应物质的性质是决定化学反应速率的主要因素
难度: 简单查看答案及解析
-
下列热化学方程式中,正确的是
A. 甲烷的燃烧热ΔH=﹣890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)====CO2(g)+2H2O(g)ΔH=﹣890.3 kJ·mol-1
B. 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g)ΔH=﹣38.6 kJ·mol-1
C. 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)====2H2O(l)ΔH=﹣571.6 kJ·mol-1
D. HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2(﹣57.3)kJ·mol-1
难度: 中等查看答案及解析
-
利用反应2NO(g)+2CO(g)
2CO2(g)+N2(g) ΔH=-746.8 kJ·mol-1 ,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 增大压强同时加催化剂
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法正确的是
①恒温时,增大压强,化学反应速率一定加快
②其他条件不变,温度越高,化学反应速率越快
③ 使用催化剂可改变反应速率,从而改变该反应过程中吸收或放出的热量
④ 3 mol•L﹣1•s﹣1的反应速率一定比1 mol•L﹣1•s﹣1的反应速率大
⑤升高温度能使化学反应速率增大,主要原因是增大了反应物分子中活化分子的百分数
⑥有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
⑦增大反应物浓度,可增大活化分子的百分数,从而使单位时间有效碰撞次数增多
⑧催化剂反应前后的质量不变,但能降低活化能,增大活化分子的百分数,从而增大反应速率
A. ②⑤⑧ B. ②⑥⑧ C. ②③⑤⑦⑧ D. ①②④⑤⑧
难度: 中等查看答案及解析
-
298 K时,各反应的平衡常数如下:①N2(g)+O2(g)
2NO(g) K=1×10-30;②2H2(g)+O2(g)
2H2O(g) K=2×1081;③2CO2(g)
2CO(g)+O2(g) K=4×10-92,则常温下,NO、H2O、CO2这三个化合物分解放氧的倾向最大的是 ( )
A. ① B. ②
C. ③ D. 无法判断
难度: 简单查看答案及解析
-
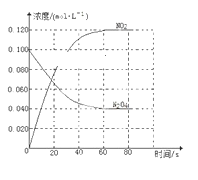
汽车尾气中NO产生的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是

A. 温度T下,该反应的平衡常数
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
难度: 中等查看答案及解析
-
下列说法中,能说明化学平衡一定向正反应方向移动的是( )
A. N2O4(g)
2NO2(g),改变某一条件后,气体颜色加深
B. H2(g)+I2(g)
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
C. N2(g)+3H2(g)
2NH3(g),改变某一条件后,NH3的体积分数增加
D. 2SO2(g) +O2(g)
2SO3(g),恒温恒压条件下,充入He
难度: 中等查看答案及解析
-
下列事实能用勒夏特列原理解释的是( )
A. 加入催化剂有利于合成氨的反应
B. 由H2(g)、I2(g)和HI(g)组成的平衡体系加压后颜色变深
C. 500 ℃时比室温更有利于合成氨的反应
D. 将混合气体中的氨液化有利于合成氨反应
难度: 中等查看答案及解析
-
已知428 ℃时,H2(g)+I2(g)
2HI(g)的平衡常数为49,则该温度下2HI(g)
H2(g)+I2(g)的平衡常数是
A. 1/49 B. 1/7 C. 492 D. 无法确定
难度: 简单查看答案及解析
-
下列关系中能说明可逆反应N2+3H2
2NH3已达到平衡状态的是
A. υ正(N2)=υ逆(NH3) B. υ正(N2)=3υ逆(H2)
C. 3υ正(N2)=υ正(H2) D. 2υ正(H2)=3υ逆(NH3)
难度: 中等查看答案及解析
-
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
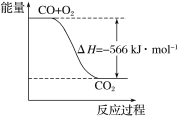
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z。反应2 min后,测得参加反应的X2为0.6 mol·L-1,用Y2的变化表示的反应速率v(Y2)=0.1 mol·L-1· min-1,生成的c(Z)为0.4 mol·L-1,则该反应的化学方程式是
A. X2+2Y2
2XY2 B. 3X2+Y2
2X3Y
C. X2+3Y2
2XY3 D. 2X2+Y2
2X2Y
难度: 中等查看答案及解析
-
一定温度下,在固定容积的密闭容器中,可逆反应:mA(g)+nB(g)
pC(g)+qD(g),当m、n、p、q为任意正整数时,下列状态:①体系的压强不再发生变化;②生成mmol A,同时消耗qmol D;③各组分的物质的量浓度不再改变;④体系的密度不再发生变化;⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q;⑥各组分的质量分数不再改变;⑦反应混合物的平均摩尔质量不再发生变化。其中一定能说明反应已达到平衡状态的是
A. ②③④⑥ B. ③⑥⑦ C. ②③⑥ D. ③⑥
难度: 中等查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
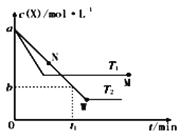
A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2 下,在 0〜t1时间内,v(Y)=b/t1 mol·L-1·min-1
C. M点的正反应速率v 正大于N点的逆反应速率v逆
D. M点时再加入一定量X,平衡后X的转化率减小
难度: 困难查看答案及解析
-
一定条件下,向一带活塞的密闭容器中充入1 mol N2和3 mol H2,发生下列反应:N2(g)+3H2(g)
2NH3(g),反应达到平衡后,改变下述条件,NH3平衡浓度不改变的是
A. 保持温度和容器压强不变,充入1 mol NH3(g)
B. 保持温度和容器体积不变,充入1 mol NH3(g)
C. 保持温度和容器压强不变,充入1 mol N2(g)
D. 保持温度和容器体积不变,充入1 mol H2(g)
难度: 中等查看答案及解析
-
已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+
H2(g)=
C2H2(g)ΔH2
③C(s)+ H2(g)=
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
难度: 简单查看答案及解析
-
右图中的曲线表示在一定条件下,2NO + O2
2NO2 △H<0,反应中NO的转化率与温度的关系。图中标出a、b、c、 d四点,其中表示未达到平衡状态,且v(正)<v(逆)的点是
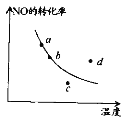
A.a点 B.b点 C.c点 D.d点
难度: 中等查看答案及解析
-
利用I2O5可消除CO污染,其反应为:反应为I2O5(s)+5CO(g)
5CO2(g)+I2(s);不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2 mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示。下列说法正确的是( )
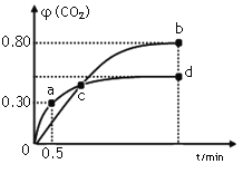
A. b点时,CO的转化率为20%
B. 容器内的压强保持恒定,表明反应达到平衡状态
C. b点和d点的化学平衡常数:Kb>Kd
D. 0到0.5 min反应速率v(CO)=0.3 mol·L-1·min-1
难度: 困难查看答案及解析
-
已知723 K时,2SO2(g)+O2(g)
2SO3(g)ΔH=﹣QkJ·mol-1,在相同条件下,向一密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出的热量为Q1kJ;向另一体积相同的密闭容器中通入1 mol SO2和0.5 mol O2,达到平衡时放出的热量为Q2kJ.则Q1、Q2、Q满足的关系是
A. Q2=Q1/2 B. Q2>Q1/2 C. Q2<Q1<Q D. Q=Q1>Q2
难度: 中等查看答案及解析
-
已知①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A. -870.3 kJ/mol B. -571.6 kJ/mol
C. +787.0 kJ/mol D. -488.3 kJ/mol
难度: 中等查看答案及解析
-
一定温度下,在固定容积、体积为2 L的密闭容器中充入1 mol N2和3 mol H2发生反应,当反应进行到10 s末时反应达到平衡,此时容器中c(NH3)=0.1mol·L-1。下列有关判断错误的是
A.反应达平衡时N2的转化率为10%
B.反应进行到10 s末时,H2的平均反应速率是0.03 mol·(L·s)-1
C.该反应达到平衡时,N2的平衡浓度为0.45 mol/L
D.该反应达到平衡时的压强是起始时压强的0.95倍
难度: 困难查看答案及解析
-
已知某反应aA(g)+bB(g)
cC(g)△H="Q" 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )

A. T1<T2,P1<P2,a+b>c,Q<0
B. T1>T2,P1<P2,a+b<c,Q>0
C. T1<T2,P1>P2,a+b<c,Q>0
D. T1<T2,P1>P2,a+b>c,Q<0
难度: 困难查看答案及解析
-
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
CO2(g)+H2(g) △H<0
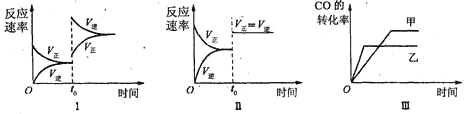
下列分析中正确的是
A、图Ⅱ研究的只是t0时使用催化剂对反应速率的影响
B、图Ⅰ研究的是t0时缩小容器体积对反应速率的影响
C、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
D、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
难度: 中等查看答案及解析
-
在一定条件下,向一带活塞的密闭容器中充入2molA和1molB,发生下列反应:2A(g)+B(g)
2C(g) △H< 0,达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图。下列对t1时刻改变条件的推测中正确的是
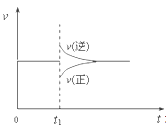
A、保持压强不变,升高反应温度
B、保持温度不变,增大容器体积
C、保持温度和容器体积不变,充入1molC(g)
D、保持温度和压强不变,充入1molC(g)
难度: 中等查看答案及解析
-
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
难度: 简单查看答案及解析
-
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a<c+d
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=c(CO).c(H2O)/[c(CO2).c(H2)]。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应的焓变为正值
B. 恒温下,增大压强,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式为CO+H2O
CO2+H2
难度: 困难查看答案及解析
-
一定条件下存在反应:H2(g) + I2(g)
2HI(g) ΔH<0,现有三个相同的体积均为 1 L 的恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入 1 mol H2和 1 molI2(g),在Ⅱ中充入 2 molHI(g),在Ⅲ中充入 2 mol H2和2 mol I2 (g),700℃条件下开始反应。达到平衡时,下列说法正确的是( )
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ中反应的平衡常数大于容器Ⅲ中反应的平衡常数
C. 容器Ⅱ中的气体颜色比容器Ⅰ中的气体颜色深
D. 容器Ⅰ中 H2的转化率与容器Ⅱ中HI的转化率之和等于1
难度: 困难查看答案及解析
-
如图是温度和压强对反应X+Y
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
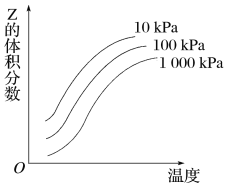
A. 上述可逆反应的正反应为放热反应
B. X、Y、Z均为气态
C. X和Y中最多只有一种为气态,Z为气态
D. 上述反应的逆反应的ΔH>0
难度: 中等查看答案及解析
-
在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是( )
已知N2(g)+3H2(g)
2NH3(g) ΔH=-92.4 kJ·mol-1

A. 2p1=2p3<p2
B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1
D. Q1+Q3=92.4
难度: 中等查看答案及解析