-
下列实验方案和实验结论正确的是
A. 除去SO2中少量的HCl,可将混合气体通入饱和Na2SO3溶液中
B. 粘在试管内壁的硫单质,可用热的稀盐酸洗涤
C. 稀盐酸、NaOH、AlCl3、Ba(OH)2四瓶无色溶液,可用NaHCO3鉴别
D. 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 元素周期表中位于金属与非金属分界线附近的元素属于过渡元素
B. 短周期第IVA族与VIIA族元素的原子间构成的分子,均满足原子最外层8电子结构
C. C、N、O、H四种元素形成的化合物一定既有离子键又有共价键
D. 第三周期非金属元素含氧酸的酸性从左到右依次增强
难度: 中等查看答案及解析
-
化学与生产、生活、环境密切相关。下列说法正确的是
A. 氧化钙和铁粉常作食品干燥剂
B. 二氧化硫有毒所以不能作食品防腐剂
C. 碳酸钡不溶于水因此在医疗上用作钡餐
D. 向蛋白质溶液中加入硫酸铜溶液产生沉淀属于化学变化
难度: 简单查看答案及解析
-
下列说法错误的是
A. 液氨汽化时要吸收大量的热,常用作制冷剂
B. 新能源汽车的推广与使用有助于减少光化学烟雾的产生
C. 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料
D. 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
难度: 简单查看答案及解析
-
下列化学用语正确的
A. 二氧化硅的结构式:O=Si=O B. COS的电子式是:
C. Cl-的结构示意图:
 D. Mg原子的电子式:Mg
D. Mg原子的电子式:Mg难度: 简单查看答案及解析
-
类比法是化学学习过程中一种重要方法,以下类比关系正确的是
A. 加热条件下,钠与氧气反应生成过氧化钠,锂与氧气反应也生成过氧化锂
B. Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐
C. 铝与氧化铁能发生铝热反应,则铝与二氧化锰也能发生铝热反应
D. 氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水
难度: 中等查看答案及解析
-
下列关于胶体的说法正确的是
A. 向Al(OH)3胶体中加入NaOH溶液至过量,有沉淀产生
B. 由于胶体带电,在电场的作用下可以在分散剂中做定向运动
C. 可用渗析的方法除去淀粉溶液中的NaCl
D. 制备Fe(OH)3胶体时需要将饱和FeCl3溶液与NaOH溶液混合
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 密闭容器中2 mol NO与2 mol O2充分反应,体系中的原子总数为8 NA
B. 100 g质量分数为9.8%的硫酸水溶液中含氧原子的数目为0.4 NA
C. 0.1mol铁在0.1mol Cl2中充分燃烧,转移的电子数为0.3 NA
D. 常温下,0.1mol·L-1的Na2SO4溶液中含有的离子总数为0.3 NA
难度: 简单查看答案及解析
-
根据相关概念下列说法正确的是
A. 只含共价键的物质一定是共价化合物
B. 氯化钠发生状态变化时,一定会破坏离子键
C. 物质中分子间的作用力越大,分子越稳定
D. 都是由非金属元素形成的化合物只能是共价化合物
难度: 中等查看答案及解析
-
根据原子结构或元素周期律的知识,下列说法正确的是
A. 35Cl和37Cl的原子核外电子排布不同
B. CO2通入Na2SiO3溶液中可以得到硅酸溶胶
C. 短周期主族元素原子最外层电子数一定等于其最高化合价
D. 1 mol HCl分子和1 mol HF分子断键需要的能量前者大于后者
难度: 中等查看答案及解析
-
下列除杂的方法正确的是
A. 除去NaCl溶液中少量CaCl2:加入过量Na2CO3,过滤
B. 除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤
C. 除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
D. 除去N2中的少量O2:通过灼热的Cu粉末,收集气体
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
B. 向次氯酸钙溶液中通入SO2气体:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO
C. 用氨水吸收足量的SO2气体:OH-+SO2 = HSO3-
D. 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑
难度: 中等查看答案及解析
-
向含有Fe3+、Fe2+、Mg2+、NH4+的水溶液中,加入足量的Na2O2固体,充分反应后再加入过量的稀盐酸,上述离子数目没有明显变化的是
A. Fe2+ B. NH4+ C. Fe3+ D. Mg2+
难度: 中等查看答案及解析
-
向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是
A. 氨气:K+、Na+、AlO2-、CO32-
B. 二氧化硫:Na+、NH4+、SO32-、C1-
C. 氯气:K+、Na+、SiO32-、NO3-
D. 乙烯:H+、K+、MnO4-、SO42-
难度: 中等查看答案及解析
-
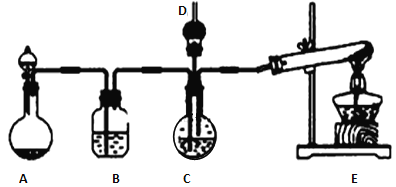
用如图的实验装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
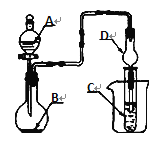
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为稀盐酸,B为石灰石,C中盛CaCl2溶液,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛A1C13溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硝酸,B为铜屑,C中盛紫色石蕊溶液,则C中溶液变红色
难度: 中等查看答案及解析
-
某阳离子为钠离子的溶液中,可能含有SO42-、CO32-、Cl-的一种或几种,只取原溶液一次,便能一一检验其中存在的阴离子。下列加入试剂的顺序最合理的是
A. HCl、BaCl2、AgNO3 B. Ba(NO3)2、AgNO3、HNO3
C. 酚酞、Ba(NO3)2、AgNO3 D. HNO3、Ba(NO3)2、AgNO3
难度: 中等查看答案及解析
-
某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
A. ①③ B. ①②③ C. ③④ D. ②③④
难度: 中等查看答案及解析
-
过氧化钠具有强氧化性,遇亚铁离子可将其氧化为一种常见的高效水处理剂,化学方程式为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑.下列说法中不正确的是
A. 氧化性:Na2O2>Na2FeO4>FeSO4
B. FeSO4只作还原剂,Na2O2既作氧化剂,又作还原剂
C. 由反应可知每3mol FeSO4完全反应时,反应中共转移12 mol 电子
D. Na2FeO4处理水时,不仅能杀菌消毒,还能起到净水的作用
难度: 中等查看答案及解析
-
硫酸铵在加热条件下分解生成氨、二氧化硫、氮气和水。反应中生成的氧化产物和还原产物的物质的量之比是
A. 1:3 B. 2:3 C. 1:1 D. 3:1
难度: 困难查看答案及解析
-
向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,所得溶液中C1-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A. 0.75 mol·L-1 B. 1mol·L-1 C. 1.5 mol·L-1 D. 2 mol·L-1
难度: 中等查看答案及解析