-
在下列溶液中,各组离子一定能够大量共存的是:( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
难度: 简单查看答案及解析
-
在氯化铵溶液中,下列关系式正确的是
A. c(Cl-)>c(NH4+)>c(H+)>c(OH-) B. c(NH4+)> c(Cl-)>c(H+)>c(OH-)
C. c(Cl-)=c(NH4+)>c(H+)=c(OH-) D. c(NH4+)= c(Cl-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述不正确的是
A. 22.4LCO2与CO的混合气体中含碳原子数为NA
B. 常温下, 1L0.1 mol·L-1的NH4NO3溶液中氮原子数为0.2 NA
C. 2.7g金属铝变为铝离子时失去的电子数目为0.3NA
D. 室温下,21.0 gC2H4和C4H8的混合气体中含有的原子数目为4.5 NA
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 氢氧化钠的电子式:
B. 质子数为53、中子数为78的碘原子:
C. 水分子比例模型:

D. 对硝基甲苯的结构简式:
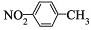
难度: 中等查看答案及解析
-
下列各组物质,前者属于电解质,后者属于非电解质的是( )
A. NaCl、BaSO4 B. 铜、二氧化硫
C. KOH、蔗糖 D. KNO3、硫酸溶液
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 漂白粉、水玻璃、冰醋酸、聚乙烯都是混合物
B. 金属氧化物一定是碱性氧化物
C. 胶体区别于其他分散系的本质特征是胶体粒子直径介于1~100nm之间
D. 淀粉、油脂和蛋白质都属于天然高分子化合物
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 漂白粉溶液中通入过量的CO2: Ca2++2ClO-+ CO2+ H2O = CaCO3↓+2HClO
B. 氯气与水的反应: Cl2+H2O
2H++Cl-+ClO—
C. NaHCO3溶液中加足量Ba(OH)2溶液:HCO3—+Ba2++OH-=BaCO3↓+H2O
D. 钠和冷水反应 : Na+2H2O=Na++2OH-+H2↑
难度: 困难查看答案及解析
-
下列说法正确的是
A. 常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B. 用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C. 在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D. 物质的溶解度都随温度的升高而增加,物质的溶解都是吸热的
难度: 简单查看答案及解析
-
能实现下列物质间直接转化的元素是( )

A. 硅 B. 硫 C. 铜 D. 铁
难度: 中等查看答案及解析
-
将NO3-+Zn+OH-+H2O → NH3+Zn(OH)42- 配平后,离子方程式中H2O的系数是
A. 2 B. 4 C. 6 D. 8
难度: 中等查看答案及解析
-
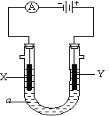
在微生物作用下电解有机废水(含CH3COOH),可获得清洁能源H2,其原理如图所示,下列有关说法不正确的是
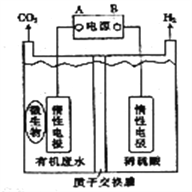
A. 电极B极为负极
B. 与电源A极相连的惰性电极上发生的反应为:CH3COOH-8e-+H2O=2CO2↑+8H+
C. 通电后,H+通过质子交换膜向右移动,最终右侧溶液PH减小
D. 通电后,若有0.1molH2生成,则转移0.2mol电子
难度: 中等查看答案及解析
-
已知4NH3(g)+5O2(g)
4NO(g)+6H2O(g),若化学反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[单位:mol/(L·s)]表示,则正确关系是
A. 4 v(NH3)=5v(O2) B. 5 v(O2)=6v(H2O)
C. 2 v(NH3)=3v(H2O) D. 4 v(O2)=5v(NO)
难度: 中等查看答案及解析
-
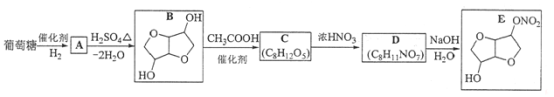
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ===2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是
A. Na2O2只作氧化剂
B. 2 mol FeSO4发生反应时,反应中共有8 mol电子转移
C. 每生成22.4L氧气就有2 mol Fe2+ 被氧化
D. Na2FeO4既是还原产物又是氧化产物
难度: 困难查看答案及解析
-
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )。
A.
B.
C.
D.
难度: 简单查看答案及解析
-
用0.1mol/LNa2SO3溶液20mL,恰好将1.0×10-3molXO4-还原,则X元素在反应后所得还原产物中化合价为
A. +3价 B. +2价 C. +1价 D. 0价
难度: 中等查看答案及解析
-
中国丝绸有五千年的历史和文化。古代染坊常用某种“碱剂”来精炼丝绸,该“碱剂”的主要成分是一种盐, 能促进蚕丝表层的丝胶蛋白杂质水解而除去,使丝绸颜色洁白、质感柔软、色泽光亮这种“碱剂”可能是
A. 草木灰 B. 火碱 C. 食盐 D. 胆矾
难度: 中等查看答案及解析
-
进行下列实验,相关说法正确的是
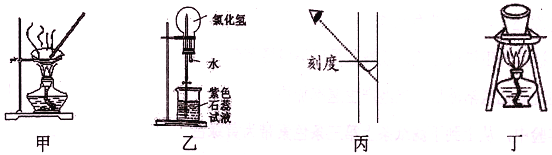
A. 图甲:蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 图乙:形成美丽的红色喷泉,证明HC1极易溶于水
C. 图丙:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
D. 图丁:所示装置用于除去碳酸氢钠固体中的少量碳酸钠
难度: 困难查看答案及解析
-
10 mL一定物质的量浓度的盐酸被一定物质的量浓度的NaOH溶液滴定的图示如下图,据图推出NaOH溶液和盐酸的物质的量浓度正确的是
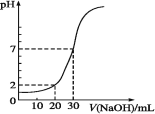
A
B
C
D
c(HCl)
0.12
0.04
0.12
0.09
c(NaOH)
0.04
0.12
0.06
0.03
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化如图,关于该反应的下列说法中,正确的是
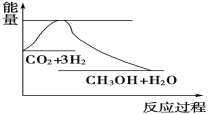
A. ΔH>0,ΔS>0 B. ΔH>0,ΔS<0 C. ΔH<0,ΔS>0 D. ΔH<0,ΔS<0
难度: 中等查看答案及解析
-
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。
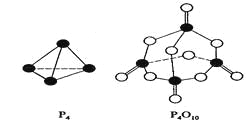
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
难度: 中等查看答案及解析
-
下列各项操作或现象能达到预期实验目的的是
选项
操作或现象
实验目的
A
将铁钉放入试管中,用盐酸浸没
验证铁的吸氧腐蚀
B
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色
证明Br—还原性强于Cl—
C
将氯化亚铁固体溶于适量蒸馏水中
配制FeCl2溶液
D
将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶
除去氯气中的HCl气体
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
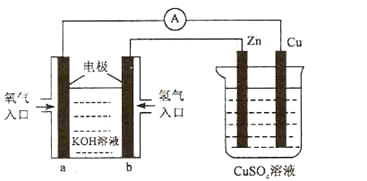
A. 该装置中Cu极为正极
B. 当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C. b极反应的电极反应式为:H2-2e-=2H+
D. 一段时间后锌片质量减少
难度: 中等查看答案及解析
-
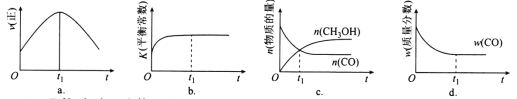
在一个2L的密闭容器中,发生反应: 2SO3 (g)
2SO2 (g)+ O2 (g) — Q (Q>0),其中SO3的物质的量随时间变化如图所示,下列判断错误的是
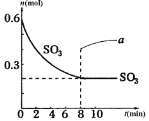
A. 0~8min内v(SO3)=0.025mol/(L·min)
B. 8min时,v逆(SO2)=2v正(O2)
C. 8min时,容器内压强保持不变
D. 若8min时将容器压缩为1L,n(SO3)的变化如图中a
难度: 中等查看答案及解析