-
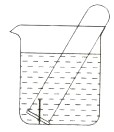
有关如图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)

A.铜片上有气泡逸出
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.反应前后铜片质量不改变
难度: 简单查看答案及解析
-
在钢铁腐蚀过程中,下列五种变化可能发生的是 ①Fe2+转化为Fe3+、②O2被还原、③产生H2、④Fe(OH)3失水形成Fe2O3·xH2O、⑤杂质碳被氧化
A.①② B.②③④ C.①②③④ D.①②③④⑤
难度: 简单查看答案及解析
-
为了降低某水库的铁闸门被腐蚀的速率,可以采取如图所示的方案,其中焊接在铁闸门上的固体材料R可以采用
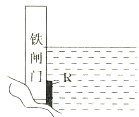
A.铜 B.钠 C.锌 D.石墨
难度: 简单查看答案及解析
-
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连可以组成几个原电池。若a、b 相连时a为负极;c、d相连时电流由d到c;a、c相连时c极上产生大量气泡;b、d相连时b上 有大量气泡产生,则四种金属的活动性顺序由强到弱为
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
难度: 简单查看答案及解析
-
“暖宝宝”取暖片的材料中含有铁粉、水、活性炭、硅石、食盐等,它们组成一个原电池,在反应时释放出热量,铁粉在原电池中充当
A.负极 B.正极 C.阴极 D.阳极
难度: 简单查看答案及解析
-
下列关于铜电极的叙述正确的是
A.铜锌原电池中铜是正极
B.用电解法精炼精铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阴极
D.电解稀硫酸制H2、O2时铜作阳极
难度: 简单查看答案及解析
-
对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法。下列有关说法中正确的是
A.电解熔融NaOH可生成金属钠、O2以及H2
B.电解熔融CaCl2时,金属钙在阳极生成
C.可用电解饱和MgCl2溶液的方法获得金属镁
D.电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解
难度: 简单查看答案及解析
-
埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是
A.在潮湿疏松透气的土壤中 B.在干燥致密不透气的土壤中
C.在含铁元素较多的酸性土壤中 D.在含碳粒较多,潮湿透气的土壤中
难度: 简单查看答案及解析
-
在理论上不能用于设计原电池的化学反应是
A.H2SO4(aq)+BaCl2(aq)=2HCl(aq)+BaSO4(s);△H<0
B.CH3CH2OH(l)+3O2(g)
2CO2(g)+3H2O(l) ;△H<0
C.4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ;△H<0
D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(l) ;△H<0
难度: 简单查看答案及解析
-
若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是 2Ag+2H+===2Ag++H2 ↑,则下列关于该装置的有关说法正确的是
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属银为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
难度: 简单查看答案及解析
-
下图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是
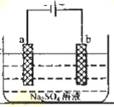
A.逸出气体的体积:a电极的小于b电极的
B.电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
难度: 简单查看答案及解析
-
关于铅蓄电池的说法正确的是
A.在放电时,正极发生的反应是 Pb(s) +SO42—(aq)-2e—= PbSO4(s)
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是 PbSO4(s)+2e—= Pb(s)+ SO42—(aq)
难度: 简单查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镶层仍能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
难度: 简单查看答案及解析
-
下列叙述正确的是
A.在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2
C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
难度: 简单查看答案及解析
-
据报道,我国拥有完全自主产权的氢氧燃料电池车将在奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
A.正极反应式为:O2+2H2O+4e-==4OH-
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2==2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
难度: 简单查看答案及解析
-
为了避免青铜器生成铜绿,以下方法正确的是
A、将青铜器放在银质托盘上 B、将青铜器保存在干燥的环境中
C、将青铜器保存在潮湿的空气中 D、在青铜器的表面覆盖一层防渗的高分子膜
难度: 简单查看答案及解析
-
在1L K2SO4和CuSO4的混合溶液中c(SO42-) = 2.0 mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中c(K+)为
A.2.0 mol•L-1 B.1.5 mol•L-1 C.1.0 mol•L-1 D.0.50 mol•L-1
难度: 简单查看答案及解析
-
用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,且电解后溶液
的pH增大的是
A.KCl B.NaOH C.Na2SO4 D.H2SO4
难度: 简单查看答案及解析
-
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成
ClO—,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式是:2Cl—-2e—=====Cl2
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子
难度: 简单查看答案及解析
-
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
难度: 简单查看答案及解析