-
相同温度下,根据三种酸的电离常数,下列判断正确的是( )
酸
HX
HY
HZ
电离常数K
9×10-7
9×10-6
1×10-2
A. 三种酸的强弱关系:HX>HY>HZ
B. 反应HZ+Y-===HY+Z-能够发生
C. 相同温度下,0.1 mol·L-1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D. 相同温度下,1 mol·L-1 HX溶液的电离常数大于0.1 mol·L-1 HX
难度: 简单查看答案及解析
-
在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是
A. 化学反应速率:乙>甲 B. 平衡后N2的浓度:乙>甲
C. H2的转化率:乙>甲 D. 平衡混合气中H2的体积分数:乙>甲
难度: 中等查看答案及解析
-
下列有关电解质的说法正确的是 ( )
A. C2H5OH(乙醇)是化合物,所以它是电解质
B. 固体Na2SO4不能导电,所以它是非电解质
C. 易溶性强电解质的溶液中不存在溶质分子
D. BaSO4难溶于水,所以BaSO4是弱电解质
难度: 简单查看答案及解析
-
已知HCl为强酸,下列对比实验不能用于证明CH3COOH为弱酸的是 ( )
A. 对比等浓度的两种酸的pH
B. 对比等浓度的两种酸,与相同大小镁条反应的初始速率
C. 对比等浓度、等体积的两种酸,与足量Zn反应,生成H2的体积
D. 相同条件下,对等浓度的两种酸进行导电实验,若与CH3COOH溶液相串联的灯泡较暗,证明CH3COOH为弱酸
难度: 中等查看答案及解析
-
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是( )
A. ③①④②⑤
B. ①③⑤④②
C. ③②①⑤④
D. ⑤②④①③
难度: 中等查看答案及解析
-
下列离子组一定能大量共存的是( )
A. pH=1 的溶液中:K+、Fe2+、SO42-、MnO4-
B. 由水电离出的c(OH-)=10-12 mol·L-1的溶液中:Fe2+、Ba2+、NO3-、ClO-
C. 含大量Al3+的溶液中:Na+、SO42-、NO3-、AlO2-
D. 能使甲基橙变红的溶液中: Na+、SO42-、 Fe3+
难度: 中等查看答案及解析
-
常温下,稀释0.1 mol·L-1 NH4Cl溶液,下图中的横坐标表示加水的量,则纵坐标可以表示的是 ( )
A. NH4+水解的平衡常数 B. 溶液的pH
C. 溶液中NH4+物质的量 D. 溶液中c(NH4+)
难度: 中等查看答案及解析
-
在密闭容器中,将一定量A、B气体混合后发生反应:xA(g)+yB(g)
zC(g)+mD(s)。平衡时测得A的浓度为0.5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.3 mol·L-1。则下列有关判断正确的是 ( )
A. B的转化率一定减小 B. x+y>z+m
C. 平衡向正反应方向移动 D. 混合气体的密度一定减小
难度: 中等查看答案及解析
-
相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
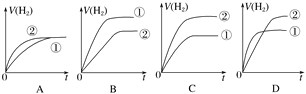
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应中,一定不能自发进行的是 ( )
A. 2KClO3(s)=2KCl(s)+3O2(g) ΔH<0
B. CO(g)=C(s石墨)+1/2 O2 (g) ΔH>0
C. 4Fe(OH)2(s)+2H2O(l)+O2(g) =4Fe(OH)3(s) ΔH<0
D. NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l) ΔH>0
难度: 中等查看答案及解析
-
(已知lg5=0.7)室温下,下列有关溶液pH的说法正确的是 ( )
A. 将pH=11的NaOH溶液加水稀释100倍,溶液中c(H+)=1×10-13 mol·L-1
B. 将pH=9的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,所得混合溶液的pH=11
C. 将0.1mol/L的H2SO4和pH=5的HCl等体积混合,所得混合溶液的pH=1
D. pH=13的Ba(OH)2溶液和pH=1的HCl等体积混合,由于Ba(OH)2过量,所得溶液的pH>7
难度: 中等查看答案及解析
-
下列溶液中浓度关系正确的是 ( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
D. 等体积、等浓度的CH3COOH溶液和CH3COONa溶液混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
难度: 中等查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如右图所示。
下列分析不正确的是
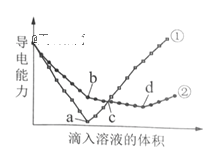
A. ①代表滴加H2 SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH–
C. c点,两溶液中含有相同量的OH–
D. a、d两点对应的溶液均显中性
难度: 困难查看答案及解析
-
25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是 ( )

A. 稀释前,c(HX) > 0.01mol/L
B. 溶液的导电性: a < b
C. a、b两点:c(X-) < c(Cl-)
D. 溶液体积稀释到10倍,HX溶液的pH < 3
难度: 中等查看答案及解析
-
25℃下列四种溶液:①c(H+)=10-3mol·L-1的醋酸;②pH=5 的NH4Cl溶液; ③pH=10的Na2CO3溶液;④c(OH-)=10-3mol·L-1氨水溶液。由水电离出的氢离子浓度之比为 ( )
A. 1∶106∶10∶1 B. 1∶106∶107∶1
C. 108∶106∶10∶1 D. 108∶106∶107∶1
难度: 中等查看答案及解析
-
己知:Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13,Ksp(Ag2CrO4)=2.0×10-12,某溶液中含有Cl-、Br-和CrO42-,浓度均为0.01mol/L,向该溶液中逐滴加入0.01mol/L的 AgNO3溶液时,三种阴离子产生沉淀的先后顺序是 ( )
A. Cl- > Br->CrO42-
B. Br- >CrO42-> Cl-
C. CrO42-> Br- >Cl-
D. Br->Cl->CrO42-
难度: 困难查看答案及解析