-
下列各组离子能够大量共存的是 ( )
A. 常温下,pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B. 常温下,水电离出的c(H+)=1×10-13mol·L-1的溶液中:K+、HCO3-、Cl-、S2-
C. 使pH试纸显蓝色的溶液中:Cu2+、Fe3+、NO3-、SO42-
D. 在AlCl3溶液中:Na+、AlO2-、SO42-、NO3-
难度: 简单查看答案及解析
-
某同学通过系统实验探究铝及其化合物的性质,操作正确且能达到目的的是
A. 向氯化铝溶液中滴加过氨水,最终得到澄清溶液
B. 等质量的铝分别与足量的盐酸和氢氧化钠溶液反应制得等质量的氢气
C. 常温下铝与浓硝酸反应制得大量的NO2
D. AlCl3溶液加热蒸干得到无水氯化铝晶体
难度: 中等查看答案及解析
-
下列离子方程式表示正确的是 ( )
A. 往FeI2溶液中通入过量氯气:Cl2+2Fe2+===2Cl-+2Fe3+
B. 将明矾溶于水中生成胶体:Al3++3H2O
Al(OH)3(胶体)+3H+
C. 大理石溶于醋酸中:CaCO3+2H+===Ca2++H2O+CO2↑
D. 铜与稀硝酸反应:3Cu+4H++2NO3-===3Cu2++2NO↑+2H2O
难度: 简单查看答案及解析
-
A. 液溴保存时用水封 B. 合成氨工业中将N2、H2和NH3中氨分离
C. 苯酚溶液置于冰水浴中变浑浊 D. 重结晶法分离氯化钠和氯化钾
难度: 中等查看答案及解析
-
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。
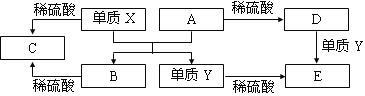
则下列说法正确的是
A. X与A反应的化学方程式是:Al2O3+ 2Fe
Fe2O3+ 2Al
B. 检验D溶液中的金属阳离子的反应:Fe3++3SCN—=Fe(SCN)3↓
C. 单质Y在一定条件下能与水发生置换反应
D. 由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
难度: 困难查看答案及解析
-
将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4。下列关于NaHSO4的说法中正确的是( )
A. 因为NaHSO4是离子化合物,因此能够导电
B. NaHSO4固体中阳离子和阴离子的个数比是2∶1
C. NaHSO4固体熔化时破坏的是离子键和共价键
D. NaHSO4固体溶于水时既破坏离子键又破坏共价键
难度: 简单查看答案及解析
-
已知酸性高锰酸钾溶液可以将FeSO4氧化,化学方程式为2KMnO4+10FeSO4+8H2SO4===K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。则下列有关说法不正确的是( )

A. 图中AB段主要是高锰酸钾和碘化钾溶液反应
B. 图中BC段发生的反应为2Fe3++2I-===2Fe2++I2
C. 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D. 根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
难度: 中等查看答案及解析
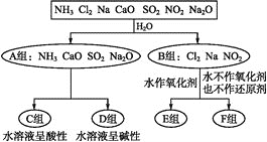
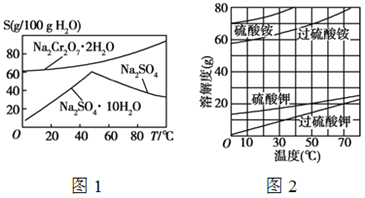
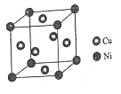
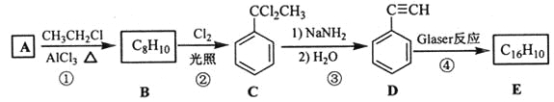
 )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。