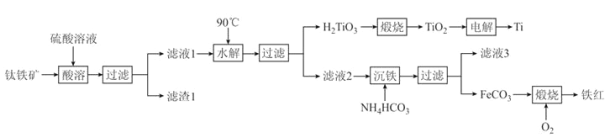
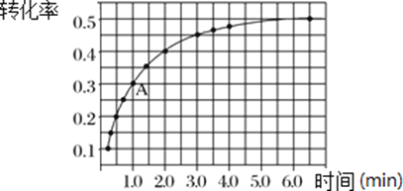
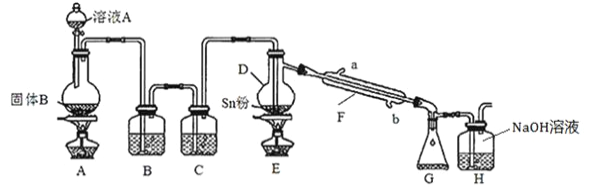
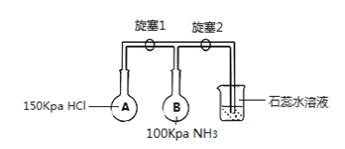
-
下列有关生活中的化学知识运用合理的是
A. 明矾可用于自来水消毒
B. 食品包装袋内的小袋铁粉主要起干燥作用
C. 工业上可用电解AlCl3溶液的方法制备金属Al
D. 工业上可用氯化铵溶液除去金属表面的氧化物
难度: 简单查看答案及解析
-
常温下,将冰醋酸加水稀释成0.01mol/L的稀醋酸溶液的过程中,以下物理量持续变小的是
A. c(H+) B. 醋酸的电离度 C. 醋酸分子的浓度 D. 醋酸的电离平衡常数
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 电解精炼铜时转移了NA个电子,阳极溶解了32g铜
B. 1mol FeCl3完全水解后可生成NA个氢氧化铁胶粒
C. 常温下,1mol氯气通入足量水中发生反应转移的电子数为NA
D. 100mL 0.1mol/L Na2CO3溶液中含有的阴离子数目大于0.01NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 氯化钠溶液导电的过程只涉及到物理变化
B. 氯化铁溶液蒸干得到氯化铁固体
C. 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的△H<0
D. 加入催化剂,能够改变可逆反应的平衡转化率,从而提高目标产物在总产物中的比例
难度: 中等查看答案及解析
-
图中所示的装置图能够达到实验目的是
A.
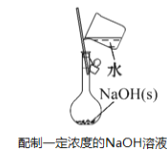 B.
B. 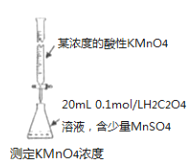
C.
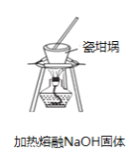 D.
D. 
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能够大量共存的是
A. 使甲基橙变黄色的溶液:Na+、K+、SO32-、Cl-
B. 含有大量Al3+的溶液:K+、Mg2+、SO42-、AlO2-
C. Kw/c(OH-) =10-3的溶液中:Cl-、NO3-、Na+、Ba2+
D. 由水电离出的c(H+)=1×10-12 mol·L-1的溶液中:NH4+、K+、CrO42-、ClO-
难度: 中等查看答案及解析
-
下列实验能达到预期目的是
编号
实验内容
实验目的
A
室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅
证明Na2CO3溶液中存在水解平衡
C
向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀
证明在相同温度下Ksp:
Mg(OH)2>Fe(OH)3
D
等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快
证明HX酸性比HY强
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验中,由于错误操作导致实验结果一定偏低的是
A. 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液的浓度
B. 滴定时盛放待测液的锥形瓶没有干燥,所测得待测液的浓度
C. 用标准氢氧化钠溶液滴定未知浓度的醋酸溶液,选甲基橙做指示剂,所测得醋酸溶液的浓度
D. 滴定管(装标准溶液)滴定前尖嘴处有气泡,滴定后无气泡,所测得待测液的浓度
难度: 中等查看答案及解析
-
如图示与对应的叙述符合的是
A. 如图可知实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化

B. 如图可知,反应C(金刚石,s) ══ C(石墨,s)的焓变ΔH ══ ΔH1-ΔH2
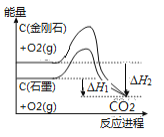
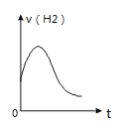
C. 如图可知表示除去氧化膜的镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D. 如图可知表示25℃时用0.1000 mol·L-1醋酸滴定40.00 mL 0.1000 mol·L-1NaOH溶液得到的滴定曲线

难度: 中等查看答案及解析
-
下列说法正确的是
A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)一定为10-7mol·L-l
B. 常温下pH =2的盐酸和pH =12的氨水等体积混合后生成NH4Cl,溶液显酸性
C. 常温下0.1 mol·L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10-10 mol·L-l
D. 常温下向CH3COONa稀溶液中加入CH3COONa固体,c (CH3COO-)/c(Na+)比值变大
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
H2CO3
HClO
HF
电离平衡常数
(25℃)
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka=2.98×10-8
Ka=3.6×10-4
下列叙述正确的是
A. Na2CO3溶液不能与次氯酸发生反应
B. 物质的量浓度相同的①NaF②Na2CO3③NaClO三种溶液的pH:③>②>①
C. 氢氟酸与NaClO溶液混合能够发生反应:HF+NaClO=HClO+NaF
D. 少量CO2通入NaClO溶液中的离子反应:CO2+H2O+2ClO-=CO32-+2HClO
难度: 中等查看答案及解析
-
锂-空气电池是一种新型的二次电池,其放电时的工作原理如图所示,下列说法正确的是
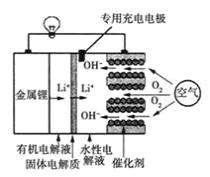
A. 该电池放电时,正极的反应式为O2+4e-+4H+=2H2O
B. 该电池充电时,阴极发生了氧化反应:Li++e-=Li
C. 电池中的有机电解液可以用稀盐酸代替
D. 充电时,空气极与直流电源正极相连
难度: 中等查看答案及解析
-
某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-
H++A2-(Ka=1.0×10-2),下列说法正确的是( )
A. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
B. 在0.1mol/L的H2A溶液中,c(H+)= 0.2 mol/L
C. 分别将浓度均为0.1mol/L的NaHA和Na2A溶液等体积混合,其pH一定大于7
D. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
难度: 中等查看答案及解析
-
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)
2NO2(g)
②2NO2(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是
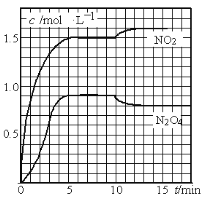
A. 前5min的平均反应速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃时反应②的化学平衡常数K=0.6
C. 反应①、②均为吸热反应
D. 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
难度: 中等查看答案及解析
-
25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中
的关系如图所示。下列说法正确的是
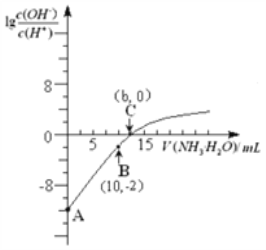
A. H2A的电离方程式为H2A
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为
难度: 困难查看答案及解析