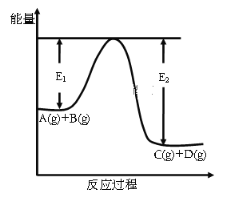
-
含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是( )
A. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=+28.7kJ/mol
B. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-28.7kJ/mol
C. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=+57.4kJ/mol
D. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.4kJ/mol
难度: 中等查看答案及解析
-
下列关于反应热的说法正确的是( )
A. 当△H为“-”时,表示该反应为吸热反应
B. 已知C(s)+1/2O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ
C. 反应热的大小与反应物所具有的能量和生成物所具有的能量无关
D. 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关
难度: 中等查看答案及解析
-
铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A. 加入适量的铝粉 B. 加入适量的水
C. 加入少量的硫酸铜溶液 D. 加入浓度较大的盐酸
难度: 中等查看答案及解析
-
室温时,下列混合溶液的pH一定小于7的是( )
A. pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
B. pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合
C. pH=3的盐酸和pH=11的氨水等体积混合
D. pH=3的硫酸和pH=11的氨水等体积混合
难度: 简单查看答案及解析
-
下列变化属于吸热反应的是( )
①液态水汽化
②将胆矾加热变为白色粉末
③浓硫酸稀释
④ 生石灰跟水反应生成熟石灰
A. ①④ B. ①② C. ② D. ②④
难度: 简单查看答案及解析
-
对下列化学反应热现象,不正确的说法是( )
A. 放热的反应,不必加热就能发生反应
B. 化学反应一定有能量变化
C. 化学反应中,吸热反应不一定需要加热也能发生
D. 热化学反应方程式中,热效应数值与反应物的物质的量的多少有关
难度: 中等查看答案及解析
-
已知反应X+Y= M+N为放热反应,对该反应的下列说法中正确的( )
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)
2CO2(g)+4H2O(l) ΔH=+1451.52 kJ·mol-1
难度: 中等查看答案及解析
-
燃烧热是指1 mol可燃物充分燃烧生成稳定氧化物时放出的热量。已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8 kJ·mol-1、-1411.0 kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的ΔH为( )
A. -44.2 kJ·mol-1 B. 44.2 kJ·mol-1 C. -330 kJ·mol-1 D. 330 kJ·mol-1
难度: 简单查看答案及解析
-
已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g )
2NH3 ( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,达到平衡时,反应放出的热量为
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
难度: 简单查看答案及解析
-
已知反应A2(g)+2B2(g)
2AB2(g)的ΔH<0,下列说法正确的是( )
A. 升高温度,正向反应速率增加,逆向反应速率减小
B. 升高温度有利于反应速率增加,从而缩短达到平衡的时间
C. 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D. 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
难度: 中等查看答案及解析
-
下列说法或表示方法正确的是( )
A. 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由C(石墨)=C(金刚石)ΔH=+1.9 kJ·mol-1可知,金刚石比石墨稳定
C. 在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)
2H2O(l) ΔH=+285.8 kJ·mol-1
D. 在稀溶液中:H++OH-
H2O ΔH=-57.3 kJ·mol-1,若将含1mol CH3COOH与含1mol NaOH的溶液混合,放出的热量小于57.3 kJ
难度: 中等查看答案及解析
-
对于反应3A=2B,根据下图,下列说法不正确的是( )

A. 该反应为吸热反应
B. 该反应一定有能量转化成了化学能
C. 反应物比生成物稳定
D. 因为生成物的总能量高于反应物的总能量,所以该反应不需要加热
难度: 中等查看答案及解析
-
在不同的条件下进行合成氨反应,N2 (g)+3H2 (g)
2NH3(g),根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
A. v(NH3)=0.1mol/(L·min) B. v(NH3)=0.2mol/(L·min)
C. v(N2)=0.3mol/(L·min) D. v(H2)=0.4mol/(L·min)
难度: 中等查看答案及解析
-
在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g)
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A. x + y < z B. B的转化率降低
C. 平衡向正反应方向移动 D. C的体积分数增大
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 该反应的化学方程式为CO+H2O
CO2+H2
C. 恒温恒容下,增大压强,H2浓度一定减小
D. 该反应的焓变为正值
难度: 困难查看答案及解析
-
分析下列反应在任何温度下均能自发进行的是(
A. 2N2(g)+O2(g)=2N2O(g) △H = +163 kJ•mol-1
B. H2O2(l)=1/2O2(g)+H2O(l) △H =-98 kJ•mol-1
C. HgO(s)=Hg(l)+1/2O2(g) △H =+91 kJ•mol-1
D. Ag(s)+1/2Cl2(g)=AgCl(s) △H =-127 kJ•mol-1
难度: 中等查看答案及解析
-
某浓度的氨水中存在下列平衡: NH3·H2O
NH4++OH—,(若想增大NH4+的浓度,而不增加OH—的浓度,应采取的措施是( )
①适当升高温度 ②加入NH4Cl固体 ③通入NH3 ④加入少量盐酸
A. ①② B. ②③ C. ③④ D. ②④
难度: 中等查看答案及解析