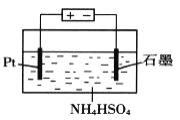
-
据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫磺)能化金银钢铁,奇物”,所得产物不可能是
A. Au2S B. Ag2S C. CuS D. FeS
难度: 简单查看答案及解析
-
下列有关实验的说法正确的是
A. 用广范pH 试纸测定氯水的pH
B. 量筒的“0”刻度在量筒的下端
C. 用棕色的碱式滴定管准确量取10.00 mL溴水
D. 用CCl4萃取碘水中的碘单质,振荡过程中不断放气
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A. 用H2O2从酸化的海带灰浸出液中提取碘:2I- +H2O2=I2+2OH-
B. 向碳酸氢铵溶液中加入过量的NaOH溶液:NH4++OH-=NH3·H2O
C. 向明矾溶液中加入Ba(OH)2溶液至生成沉淀的物质的量最多Al3++2SO42-+2Ba2++4OH-=[Al(OH)4]-+2BaSO4↓
D. 等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 困难查看答案及解析
-
化学与生产、生活密切相关,下列有关说法正确的是
A. 高硬度的氮化硅陶瓷属于传统无机非金属材料
B. 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果
C. 小苏打是制作面包等糕点的膨松剂,苏打是治疗胃酸过多的一种药剂
D. 乙醇、氯水、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
难度: 简单查看答案及解析
-
下列说法正确的是
A. 由NaH2PO2是正盐可推知H3PO2是一元酸
B. Mg、Al、Cu 可以分别用置换法、直接加热法和电解法冶炼得到
C. 工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的
D. HClO4、Al(OH)3、CH3COONa 和NO2 分别属于酸、碱、盐和酸性氧化物
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 一定条件下,乙酸能够与CuO反应,而乙醇不能
B. 甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应
C. 纤维素和油脂都是能发生水解反应的高分子化合物
D. 乙烯、乙炔、乙醛、甲苯都能与溴水或酸性KMnO4溶液反应
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法不正确的是
A. 100mL l mol·L-1KClO溶液中,阴离子的数目大于0.1NA
B. 14g乙烯和丙烯混合气体中含有C—H共价键的数目为2NA
C. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
D. 含0.4molHNO3的浓硝酸与足量铜反应,转移的电子数等于0.2NA
难度: 中等查看答案及解析
-
用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的是
实验目的
实验方案
玻璃仪器
A
除去KNO3中少量NaCl
将混合物制成热的浓溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B
证明CH3COOH的酸性强弱
用pH试纸测定0.1mol/LCH3COONa溶液的pH
玻璃棒
玻璃片
C
证明AgBr的溶度积比AgCl小
向AgNO3溶液中先滴加NaCl溶液,出现白色沉淀后,再向其中滴加同浓度的NaBr溶液
试管、滴管
D
配制1L16%的CuSO4溶液(溶液密度≈1g/mL)
将25gCuSO4·5H2O溶解在975g水中
烧杯、量筒、玻璃棒
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
葡萄酒中常加入亚硫酸盐作为食品添加剂,为检测某葡萄酒样品中亚硫酸盐的含量(通常以酒样中SO2的量计),某研究小组设计了如下实验(已知还原性:SO32->I->Cl-)。下列说法不正确的是
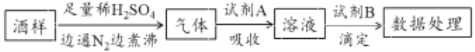
A. 葡萄酒中加亚硫酸盐的主要目的是防止氧化,利用了亚硫酸盐的还原性
B. 通入N2和煮沸的目的是为了将产生的气体从溶液中全部赶出
C. 若试剂A选择氯水,则试剂B可选择NaOH标准液
D. 若试剂A选择碱液,调节吸收后溶液为中性,则试剂B可选择I2标准液
难度: 中等查看答案及解析
-
下列化学实验事实及解释都正确的是
A. 向Na2SO3溶液中加入硝酸酸化的Ba(NO3)2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质
B. 向某溶液中加入盐酸产生无色气体,该气体能使澄清石灰水变浑浊,说明该溶液中一定有CO32-
C. 向某溶液中加入BaCl2溶液,产生白色沉淀,加稀硝酸后,白色沉淀不溶解,说明该溶液中一定含有SO42-
D. 取少量久置的Na2SO3样品溶于水,加足量盐酸有气体产生,然后加BaCl2溶液,产生白色沉淀,说明Na2SO3样品已部分变质
难度: 中等查看答案及解析
-
烧瓶中,铜与浓硫酸反应结束后,铜片未完全溶解。若向反应后的溶液中加入相关物质,下列说法正确的是
A. 滴加浓NaOH溶液立即有蓝色沉淀生成
B. 加入铁粉,铁粉不溶解
C. 通入O2并加热,铜片继续溶解
D. 加入NaNO3固体,铜片不溶解
难度: 中等查看答案及解析
-
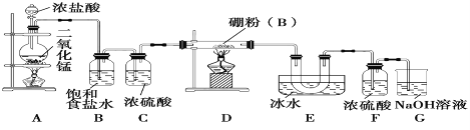
下列有关实验装置(夹持和尾气处理装置已省略)进行的相应实验,不能达到实验目的的是
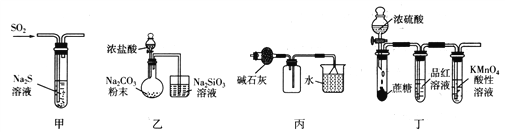
A. 利用甲装置,验证SO2或H2SO3具有氧化性
B. 利用乙装置,验证元素的非金属性:C1>C>Si
C. 利用丙装置,进行NH3的干燥、收集、尾气处理
D. 利用丁装置,验证浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
难度: 困难查看答案及解析
-
将0.1mol Cl2通入100mL含等物质的量HBr与H2SO3的混合溶液中,有一半的HBr被氧化,则下列说法正确的是
A. 物质的还原性:HBr>H2SO3>HCl
B. HBr与H2SO3的物质的量浓度均为0.6mol·L-1
C. 通入0.1molCl2发生反应的离子方程式为:5Cl2+4H2SO3+2Br-+4H2O=4SO42-+Br2+10Cl-+16H+
D. 若再通入0.05mol Cl2,恰好能将HBr和H2SO3完全氧化
难度: 中等查看答案及解析
-
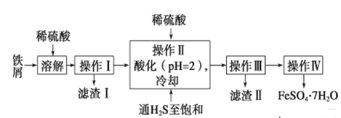
某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质。为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法正确的是( )
A. 起始滤液常温下pH=7 B. 试剂Ⅰ为 Ba(NO3)2溶液
C. 上图过程须经2次过滤 D. 步骤③的目的是除去 CO32-
难度: 简单查看答案及解析
-
以下图像与相对应的反应情况分析正确的是
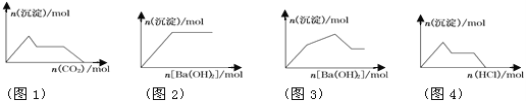
A. 图1:向含KOH和Ca(OH)2的混合溶液中缓慢通入CO2
B. 图2:向NaHSO4溶液中逐滴加入Ba(OH)2溶液
C. 图3:向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. 图4:向Na[Al(OH)4]溶液中逐滴加入盐酸
难度: 中等查看答案及解析
-
中学化学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件已略去)。下列推断错误的是
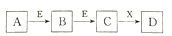
A. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
B. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
C. 若D是一种强碱,则A.B.C均可与X反应生成D
D. 若D是一种强酸,则A 既可是单质也可是化合物,且D 可与铜反应生成B或C
难度: 中等查看答案及解析
-
取一定质量的Cu、Cu2O、CuO的固体混合物,将其分成两等份。其中一份通入足量的氢气充分反应后固体质量为25.6g,另一份加入500mL稀硝酸中固体恰好完全溶解并产生标准状况下的NO气体4.48L。已知Cu2O+2H+=Cu+Cu2++H2O。则稀硝酸的浓度为
A. 4mo1·L-1 B. 2mo1·L-1 C. 1.6mo1·L-1 D. 0.8mo1·L-1
难度: 中等查看答案及解析
-
pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
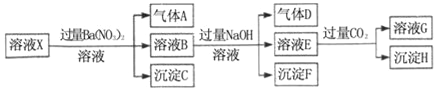
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06mol•L﹣1
难度: 困难查看答案及解析