-
在厨房里对水进行下列操作,能促进水的电离的是( )
A. 加入少量酒精 B. 加入少量食醋
C. 把水放入冰箱中使其降温至1℃ D. 把水加热至沸腾
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
A. 焓变是影响反应是否具有自发性的一个重要因素
B. 冰融化的过程中,熵值增加
C. 铁生锈和氢燃烧均为自发放热过程
D. 可以通过改变温度或加催化剂的办法使非自发反应转变为自发反应
难度: 中等查看答案及解析
-
在实验或生活中为了控制反应速率,下列做法不正确的是( )
A. 用氯酸钾制取氧气时可加入少量的高锰酸钾以加快反应速率
B. 为加快制取氢气的速率用粗锌粒代替纯锌粒
C. 为降低硫酸与Cu反应制备SO2的速率可以采用稀硫酸代替浓硫酸
D. 为了延长食品的保质期在食品包装袋中加入硅胶、硫酸铁
难度: 简单查看答案及解析
-
下列关于能量转换的认识中不正确的是
A. 电解水生成氢气和氧气时,电能转化为化学能
B. “生物质能”主要指用树木、庄稼、草类等植物直接或间接提供的能量,因此利用生物质能就是间接利用太阳能
C. 煤燃烧时,化学能主要转化为热能
D. 葡萄糖在人体组织中发生缓慢氧化时,热能转化为化学能
难度: 简单查看答案及解析
-
实验测得25℃、101 kPa时,1 mol甲醇完全燃烧释放726.51kJ的热量,下列热化学方程式书写正确的是( )
A. 2CH3OH+3O2=2CO2+4H2O ΔH=-1453.02 kJ·mol-1
B. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=+1453.02 kJ·mol-1
C. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-726.51 kJ·mol-1
D. CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-726.51 kJ·mol-1
难度: 中等查看答案及解析
-
下列物质间的反应,其能量变化符合如图的是

A. 甲烷的燃烧 B. 灼热的炭与二氧化碳反应
C. Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D. 碳酸钙的分解
难度: 简单查看答案及解析
-
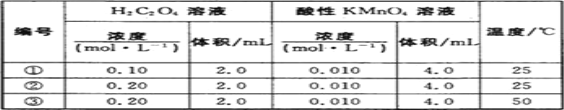
在不同条件下进行反应:2A(s)+B(g)
3C(g)+4D(g),分别测得了如下反应速率数据,其中反应速率最快的是
A. v(A)=0.7 mol·L-1·s-1 B. v(B)=0.3 mol·L-1·s-1
C. v(C)=0.8 mol·L-1·s-1 D. v(D)=1.0 mol·L-1·s-1
难度: 简单查看答案及解析
-
关于常温下pH=12的稀氨水,下列叙述不正确的是
A. 溶液中c (OH-)=1.010-2 mol·L-1
B. 由水电离出的c (OH-)=1.010-12 mol·L-1
C. 加水稀释后,氨水的电离程度增大
D. 加入少量NH4Cl固体,溶液pH变大
难度: 简单查看答案及解析
-
下列关于电离平衡常数(K)的说法中正确的是( )
A. 电离平衡常数(K)与温度无关
B. H2CO3的电离常数表达式
C. 同温下,电离平衡常数越小表示弱电解质电离能力越弱
D. 多元弱酸各步电离平衡常数相互关系为:K1<K2<K3
难度: 中等查看答案及解析
-
下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2
CO+H2O的平衡常数表达式为K==
难度: 中等查看答案及解析
-
下列事实能说明醋酸是弱电解质的是
①醋酸与水能以任意比互溶; ②醋酸溶液能导电;
③醋酸稀溶液中存在醋酸分子; ④常温下,0.1mol/L醋酸的pH比0.1mol/L盐酸的pH大;
⑤醋酸能和碳酸钙反应放出CO2;⑥大小相同的铁片与同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢;
A. ②⑥ B. ③④⑤ C. ③④⑥ D. ①②
难度: 中等查看答案及解析
-
键能是指破坏(或形成)1 mol化学键所吸收(或放出)的能量。化学反应就是旧键的断裂和新键的形成的过程。现查得:H—H、H—O和O=O的键能分别为a kJ/mol、b kJ/mol和c kJ/mol,请用此数据估计,由H2(g)、O2(g)生成1 mol H2O(g)时的热效应
A. 放热(a+c/2-2b) kJ B. 吸热(a+c/2-2b) kJ
C. 放热(2b-a-c/2) kJ D. 吸热(2b-a-c/2) kJ
难度: 中等查看答案及解析
-
已知:①2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol-1②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1。下列说法中错误的是 ( )
A. ①式表示25 ℃,101 kpa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ
B. 2H2(g)+O2(g)===2H2O(g)中ΔH大于-571.6 kJ·mol-1
C. 将含1 mol NaOH的水溶液与50 g 98%的硫酸溶液混合后放出的热量为57.3 kJ
D. 将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ
难度: 简单查看答案及解析
-
将4 mol A气体和1mol B气体在2 L的容器内混合,在一定条件下发生反应: 2A(g) +B(g)
3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
A. 用物质A表示反应的平均速率为v(A)= 0.4 mol·(L·min)-1
B. 2 min时A、B、C三种气体的总量为5mol
C. 2 min时B的转化率为20%
D. 若2 min后该反应达平衡,则各种气体的量不再变化,反应停止
难度: 简单查看答案及解析
-
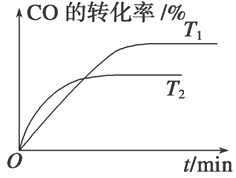
已知某可逆反应:mA(g)+nB(g)
pC(g);△H 在密闭容器中进行,如图所示,反应在不同时间t,温度T和压强P与反应物B在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是( )
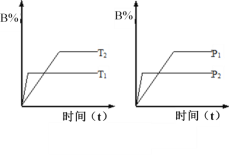
A. T1<T2,P1>P2,m+n>p,△H>0
B. T1>T2,P1<P2,m+n>p,△H>0
C. T1>T2,P1<P2,m+n<p,△H<0
D. T1>T2,P1>P2,m+n>p,△H<0
难度: 困难查看答案及解析
-
在一密闭容器中,反应aA(g)
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的65%,则
A. 平衡向逆反应方向移动了 B. 物质B的质量分数增加了
C. 物质A的转化率减小了 D. a>b
难度: 中等查看答案及解析
-
可逆反应2NO2(g)
2NO(g)+O2(g)在体积固定的密闭容器中,达到平衡状态的标志是( )
①单位时间内生成nmol O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦
C. ①③④⑤ D. 全部
难度: 中等查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g) △H<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动 ②升高温度,平衡向逆反应方向移动,v(正)减小 ③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,平衡向正反应方向移动 ⑤加入催化剂,B的转化率提高
A. ①② B. ③ C. ④ D. ④⑤
难度: 简单查看答案及解析
-
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 加入少量CH3COONa晶体
C. 加少量冰醋酸 D. 加水
难度: 中等查看答案及解析
-
温度为T1(T1=25℃)和T2时,水溶液中水的离子积曲线如图所示:下列判断错误的是( )
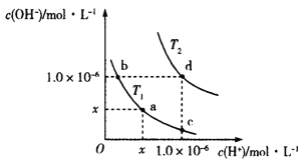
A. T2>25℃ B. x=1.0×10﹣7
C. KW(a)=KW(d) D. b点溶液呈碱性,c点溶液呈酸性
难度: 简单查看答案及解析