-
2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
难度: 中等查看答案及解析
-
中国不少古诗词清晰描绘了当时人民的生活和社会的发展,如刘禹锡的浪淘沙“日照澄州江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识正确的是
A. “沙中浪底来”指的是金的氧化物 B. 淘金原理与化学上的萃取一致
C. 雾的分散质粒子直径范围是1-100nm D. 沙子的主要成分是Si
难度: 简单查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A. 用H2O2从酸化的海带灰浸出液中提取碘:2I- +H2O2=I2+2OH-
B. 向碳酸氢铵溶液中加入过量的NaOH溶液:NH4++OH-=NH3·H2O
C. 向明矾溶液中加入Ba(OH)2溶液至生成沉淀的物质的量最多Al3++2SO42-+2Ba2++4OH-=[Al(OH)4]-+2BaSO4↓
D. 等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 困难查看答案及解析
-
下列物质的电子式书写正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是
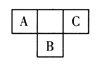
A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
难度: 困难查看答案及解析
-
下列叙述中不正确的是( )
A. 向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaOH饱和溶液,又有CaCO3沉淀生成
B. 向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成CO2与原Na2CO3物质的量之比为1∶1
C. 等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积前者多
D. 向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
难度: 中等查看答案及解析
-
下列各种关于酸的使用,其中正确的是
A. 为了抑制Fe2+的水解,用稀硝酸酸化 B. 检验溶液中是否含有SO
时,先用盐酸酸化
C. 乙酸与乙醇的酯化反应中,浓硫酸起到了催化剂和脱水剂的作用 D. 为了增强KMnO4溶液的氧化能力,用浓盐酸酸化
难度: 简单查看答案及解析
-
某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
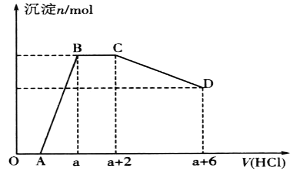
A. BC段是OH-与盐酸反应
B. 反应后最终溶液中的溶质只有NaC1
C. 原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为3:4
D. 原溶液中一定含有的离子是Na+、OH-、SiO32-、SO42-、[A1(OH)4]-、CO32-
难度: 困难查看答案及解析
-
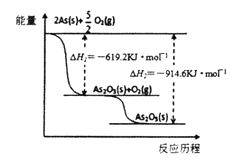
已知1 mol红磷转化为1 mol白磷,吸收18.39 kJ热量.
①4P(红,s)+5O2(g)=2P2O5(s) ΔH1
②P4(白,s)+5O2(g)=2P2O5(s) ΔH2
则ΔH1与ΔH2的关系正确的是
A. ΔH1=ΔH2 B. ΔH1>ΔH2 C. ΔH1<ΔH2 D. 无法确定
难度: 中等查看答案及解析
-
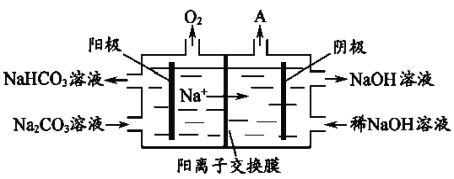
实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
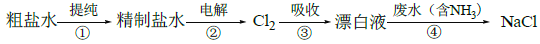
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
难度: 中等查看答案及解析
-
根据SO2通入不同溶液中实验现象,所得结论不正确的是
溶液
现象
结论
A
含HCl、BaCl2的
溶液
产生白色沉淀
SO2有还原性
B
H2S溶液
产生黄色沉淀
SO2有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3>H2SiO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
利用SCR技术可有效降低柴油发动机NOx排放。SCR工作原理为尿素[CO(NH2)2]水溶液热分解为NH3和CO2,再利用NH3转化NOx,装置如图所示:
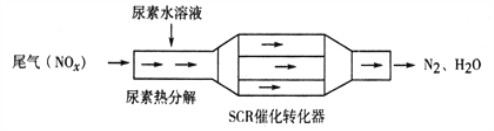
下列说法不正确的是( )
A. 尿素水溶液热分解反应不属于氧化还原反应
B. 转化器工作过程中,当转移0.6mol电子时,会消耗4.48L NH3
C. 该装置转化NO时,还原剂与氧化剂物质的量之比为2:3
D. 转化NO2过程的化学方程式为:8NH3+6NO2
2N2+12H2O
难度: 困难查看答案及解析
-
一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。
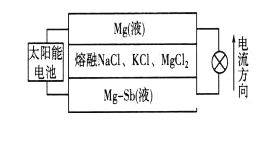
下列说法不正确的是
A. 放电时,Mg(液)层的质量减小
B. 放电时.正极反应为:Mg2++2e-=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1- 有向下层移动的趋势
难度: 中等查看答案及解析
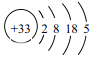 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。