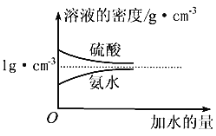
-
现有①MgSO4 ②Ba(NO3)2 ③NaOH ④CuCl2四种溶液,不加其他试剂就可鉴别出来,鉴别的先后顺序是( )
A. ④③①② B. ③④①② C. ②①③④ D. ③④②①
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列说法不正确的是
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C. “青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属于化学变化
D. “春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
难度: 中等查看答案及解析
-
下列各物质含少量杂质,除去这些杂质应选用的试剂或操作方法正确的是
序号
物质
杂质
除杂应选用的试剂或操作方法
①
KNO3溶液
KOH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CuSO4
加入过量铁粉,并过滤
③
H2
CO2
通过盛NaOH溶液的洗气瓶
④
NaNO3固体
CaCO3
溶解,过滤、蒸发
A. ②④ B. ②③④ C. ①③④ D. ①②③④
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中正确的是
A. 常温常压下,11.2 L CO2所含的原子数为1.5NA
B. 常温常压下,34 g OH-含有的质子数为20NA
C. 1L0.5mol·L-lFeCl3溶液完全转化可制得0.5NA个Fe(OH)3胶粒
D. 标准状况下,22.4 L NH3所含电子数为10NA
难度: 简单查看答案及解析
-
已知:①2K2CrO4+H2SO4
K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4
3Fe2(SO4)3+ Cr2(SO4)3 +K2SO4+7H2O
③Fe2(SO4)3+2HI
2FeSO4+I2+H2SO4
下列结论正确的是
A. ①②③均是氧化还原反应
B. 氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C. 反应②中氧化剂与还原剂的物质的量之比为6∶1
D. 反应③中0.1 mol还原剂共失去电子数为6.02×1023
难度: 中等查看答案及解析
-
下列实验能达到实验目的且符合安全要求的是
A. 利用排空气法收集二氧化碳
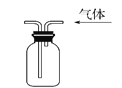 B. 收集氧气
B. 收集氧气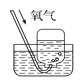 C. 制备并检验氢气的可燃性
C. 制备并检验氢气的可燃性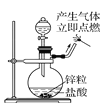 D. 稀释浓硫酸
D. 稀释浓硫酸
难度: 简单查看答案及解析
-
三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
难度: 中等查看答案及解析
-
在强酸性溶液中能大量共存的无色透明离子组是
A. K+、Na+、NO3-、MnO4- B. K+、Na+、Br-、CO32-
C. Mg2+、Na+、Cl-、SO42- D. Na+、Ba2+、OH-、SO42-
难度: 简单查看答案及解析
-
80 g密度为 ρ g·cm−3的CaCl2溶液里含2 g Ca2+,从中取出一半的溶液中Cl−的浓度是
A.
mol·L−1 B. 1.25ρ mol·L−1
C.
mol·L−1 D. 0.63 mol·L−1
难度: 中等查看答案及解析
-
一定温度下,将少量生石灰放入一定量饱和石灰水中,搅拌并冷却到原温度,下列说法正确的是( )
A. 溶质的质量增大 B. 溶质的物质的量浓度增大
C. c(OH-)不变 D. 溶质的质量分数增大
难度: 中等查看答案及解析
-
已知一个N2O3分子的质量为a g,一个N2O5分子的质量为b g,若以一个氧原子质量的
作为相对原子质量的标准,则NO2的相对分子质量为
A. 8(b+a)/(b-a) B. 16(b+a)/(b-a) C. 8(b-a)/(b+a) D. 16(b-a)/(b+a)
难度: 中等查看答案及解析
-
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C = 砒霜。下面有关解释不正确的应该是 ( )
A. 青菜中含有维生素C B. 维生素C具有还原性
C. 致人中毒过程中砷发生还原反应 D. 砒霜是氧化产物
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
B. 碳酸钡和稀硫酸反应:BaCO3+2H+=Ba2++CO2↑+H2O
C. 醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
D. Fe2+与H2O2在酸性溶被中的反应:2Fe2++H2O2+2H+=-2Fe3++2H2O
难度: 中等查看答案及解析
-
同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
难度: 困难查看答案及解析
-
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25.0mL 0.100 mol·L-1的Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化为( )
A. S2- B. S C. SO32- D. SO42-
难度: 中等查看答案及解析
-
已知氧化性: Cl2>Br2>Fe3+>I2,则下列离子方程式正确的是
A. 少量氯气与FeBr2溶液反应Cl2+2Br-=2C1-+Br2
B. 过量氯气与FeBr2溶液反应Cl2+Fe2++2Br-=2Cl-+Br2+Fe3+
C. 氯气与FeBr2溶液以物质的量1:1反应2Cl2+2Fe2++2Br-=4Cl-+Br2+2Fe3+
D. 少量氯气与FeI2溶液反应Cl2+2Fe2+=2Cl-+2Fe3+
难度: 困难查看答案及解析