-
化学与生活、社会发展息息相关,下列说法不正确的是
A. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C. “青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属于化学变化
D. “春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应
难度: 中等查看答案及解析
-
下列物质的分类正确的是
酸
碱
盐
酸性氧化物
碱性氧化物
A
H2SO4
Na2CO3
Cu2(OH)2CO3
SO3
Fe2O3
B
HCl
NaOH
NaCl
CO2
Na2O2
C
NaHSO4
NaOH
CaF2
SO2
MgO
D
HNO3
KOH
NaHCO3
Mn2O7
CaO
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
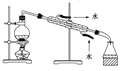
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是
选项
A
B
C
D
实验
用CCl4提取溴水中的Br2
石油的分馏
从KI和I2的固体混合物中回收I2
配制100mL0.1000 mol·L-1 KCl溶液
装置或仪器

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将金属钠分别投入下列物质的稀溶液中,有气体放出且有沉淀生成的是
A. 稀盐酸 B. NH4Cl C. CuCl2 D. NaOH
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 人们已知道了107 种元素,即已经知道了107 种原子
B. 互为同位素的原子,它们原子核内的中子数一定不相等
C. 40K 和 40Ca 原子核内的中子数相等
D. 质子数相同的微粒,核外电子数一定相同,但化学性质不一定相同
难度: 简单查看答案及解析
-
下列物质中质量最大的是
A. 1mol 硫酸 B. 22.4L标况下的水
C. 44.8L标况下的O2 D. 12.04 1023个NH3分子
难度: 简单查看答案及解析
-
某无色透明的溶液中能大量共存的离子组是
A. Al3+、Cu2+、SO42-、Cl- B. Ba2+、K+、SO42-、NO3-
C. NH4+、Mg2+、SO42¯、Cl- D. Na+、Ca2+、Cl-、CO32-
难度: 简单查看答案及解析
-
现有三组溶液:①汽油和氯化钠混合溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液。分离以上混合液中各组分的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸发、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
难度: 简单查看答案及解析
-
下列有关物质性质和用途正确的是
A. 工业上可以利用石灰水与氯气反应制备漂白粉
B. 明矾可用于自来水的杀菌消毒
C. Na-K合金可作为原子反应堆的导热剂
D. Na2CO3能与盐酸反应,广泛用于治疗胃酸过多
难度: 简单查看答案及解析
-
有BaCl2和NaCl的混合溶液VL,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗amolH2SO4、bmolAgNO3。则原混合溶液中的c(Na+)为
A.
mol/L B.
mol/L C.
mol/L D.
mol/L
难度: 困难查看答案及解析
-
1L浓度为1 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
A. 通入标准状况下的HCl气体22.4 L
B. 将溶液加热浓缩到0.5 L
C. 加入10.00mol·L-1的盐酸0.2 L,再稀释至1.5 L
D. 加入2 L 1mol·L-1的盐酸混合均匀
难度: 中等查看答案及解析
-
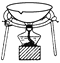
如下图所示,A处通入干燥Cl2,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的是

A.浓H2SO4 B.浓盐酸 C.NaOH溶液 D.饱和NaCl溶液
难度: 中等查看答案及解析
-
将定量的Na2CO3和NaHCO3的混合物加热到不再放出气体时,收集到CO2aL,冷却后向残余物中加入足量盐酸又收集到CO2 2 aL (体积均在标准状况下测定)。则混合物中Na2CO3和NaHCO3的物质的量之比为( )
A. 1:1 B. 1:2 C. 1:3 D. 1:4
难度: 简单查看答案及解析