-
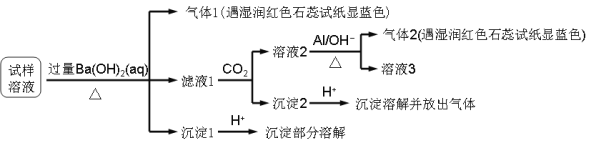
下列关于物质或离子检验的叙述正确的是
A. 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B. 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C. 灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D. 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
难度: 中等查看答案及解析
-
下列物质与其用途相符合的是( )
①NH3—工业上制HNO3 ②SiO2—太阳能电池 ③碘元素—预防甲状腺肿大 ④Al2O3—耐火材料
A. ①③ B. ②③ C. ②④ D. ①③④
难度: 简单查看答案及解析
-
下列说法正确的是
A. 所有物质燃烧必须有氧气
B. 金属钠着火时可以使用泡沫灭火器灭火
C. 不能用玻璃塞的试剂瓶长期盛放氢氧化钠溶液
D. 置换反应中的反应物单质一定是还原剂
难度: 简单查看答案及解析
-
下列关于化学键的叙述正确的是
A. 离子化合物中只含有离子键
B. 单质分子中均不存在化学键
C. 含有非极性键的化合物一定是共价化合物
D. 共价化合物分子中一定含有极性键
难度: 简单查看答案及解析
-
下列各组离子在水溶液中能大量共存的是
A. K+、H+、SiO32-、SO42-
B. Na+、K+、OH-、SO32-
C. Na+、Cl-、H+、ClO-
D. Fe2+、Na+、AlO2-、OH-
难度: 中等查看答案及解析
-
根据下列反应,推断氧化性强弱顺序正确的是
①2Fe2++Cl2=2Fe3++2 Cl-
②HClO+HCl=Cl2↑+H2O
③Cu+2Fe3+=2Fe2++Cu2+
A. Cl2>HClO>Cu2+ B. HClO>Cl2>Fe3+
C. Cl2>Cu2+>Fe3+ D. Fe3+>Cu2+>HClO
难度: 中等查看答案及解析
-
一定温度下,向饱和碳酸钠溶液中通入足量的CO2气体,忽略溶液体积的变化,下列有关说法中正确的是
A. 溶液出现浑浊现象 B. 溶液的pH变大
C. c(Na+)不变 D. 溶液中不存在CO32-
难度: 中等查看答案及解析
-
下列离子方程式中正确的是
A. 澄清的石灰水与盐酸反应Ca(OH)2+H+=Ca2++2H2O
B. NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C. 向FeI2溶液与过量氯水的反应2Fe2++Cl2=2Fe3++2Cl-
D. 过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
N0为阿伏伽德罗常数的值,下列说法正确的是
A. 18 g D2O和18 g H2O中含有的质子数均为10N0
B. 2 L 0.5 mol·L-1亚硫酸溶液中含有的H+数为2N0
C. 过氧化钠与水反应时,生成0.1mol O2转移的电子数为0.2N0
D. 50 mL 18.4 mol·L-1浓硫酸与足量铜微热,反应生成SO2分子的数目为0.46N0
难度: 简单查看答案及解析
-
配制一定物质的量浓度的稀硫酸,下列情况会使配制结果偏大的是
①溶解后未冷却即转移、定容
②定容时仰视容量瓶刻度线
③用量筒量取一定体积的浓硫酸时俯视
④将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
A. ①② B. ②③
C. ①④ D. ②③④
难度: 简单查看答案及解析
-
X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构。下列说法正确的是
A. 离子半径:X2->Z->Y+ B. 单质沸点:X>Y>Z
C. 原子最外层电子数:Y>Z>X D. 原子序数:Y>X>Z
难度: 中等查看答案及解析
-
在稀硫酸中加入铜粉,铜粉不溶解,再加入下列固体粉末,铜粉可以溶解的是
A. Fe B. Na2SO4 C. KNO3 D. FeCl2
难度: 中等查看答案及解析
-
下列有关元素的说法正确的是
A. ⅠA族与ⅦA族元素间一定形成离子化合物
B. 第二周期元素从左到右,最高正价从+1递增到+7
C. 同周期金属元素的化合价越高,其原子失电子能力越强
D. 元素周期表中的117号元素(Uus)位于第七周期、ⅦA族
难度: 简单查看答案及解析
-
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中 T 所处的周期序数与族序数相等。下列判断不正确的是
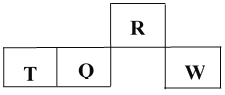
A. 最简单气态氢化物的热稳定性:R > Q
B. 最高价氧化物对应水化物的酸性:Q < W
C. R的最高价氧化物对应水化物是强电解质
D. 含T元素的盐溶液一定显酸性
难度: 中等查看答案及解析
-
下列说法正确的是
A. 在pH=1的溶液中可能含大量离子:Na+、Fe2+、NO3-、Cl-
B. 二氧化硫通入紫色石蕊溶液中,溶液褪为无色
C. 等物质的量浓度、等体积的氢氧化钡溶液与明矾溶液混合,离子方程式为:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
D. 将标况下6.72LCl2通入400mL1mol/L FeBr2溶液中,离子方程式为:3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2
难度: 困难查看答案及解析
-
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0 mol/L 的NaOH溶液1.0 L,此时溶液呈中性,铜离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2:1
B. 产生的NO在标准状况下的体积为5.6 L
C. 硝酸的物质的量浓度为2.4 mol/L
D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol
难度: 困难查看答案及解析
-
已知X、Y、Z、E四种常见物质含有同一种元素,其中E是一种强酸,在一定条件下,它们有如图所示转化关系。下列推断不合理的是

A. X可能是一种氢化物
B. Y可能直接转化为E
C. Y不可能转化为X
D. 若X是单质,则X转化为Y的反应可能是化合反应
难度: 中等查看答案及解析