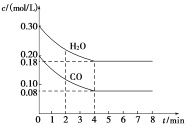
-
下列各离子浓度的大小比较,正确的是( )
A. 0.2mol/L Na2CO3 溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B. 0.01mol/L 的 NH4Cl 溶液与 0.05mol/L NaOH 溶液等体积混合显碱性:c(Cl-)> c(NH4+) > c(Na+) >c(OH-)>c(H+)
C. 常温时,将等体积的盐酸和氨水混合后,pH=7,则 c(NH4+)>c(Cl-)
D. 同浓度的下列溶液中:①(NH4)2SO4②NH4HCO3③ NH4Cl,④NH3·H2O,c(NH4+)由大到小的顺序是:①>③>②>④
难度: 中等查看答案及解析
-
下列关于化学反应说法中正确的是
A. 化学键的断裂和形成是化学反应中能量变化的主要原因
B. 化学反应速率为0.8 mol /(L·s)是指1s 内生成0.8mol该物质
C. 可逆反应达到平衡时,各物质的质量不变,
D. 化学反应的限度不可以通过改变条件而改变
难度: 中等查看答案及解析
-
已知:A(g)+2B(g)
C(g)+D(g) △H<0,一定温度下,2molA和2molB在2L密闭容器中反应,10min后达到平衡,此时容器压强降为原来的4/5,下列叙述正确的是
A. 从开始到平衡,A的反应速率为0.08mol·L
·min
B. 随着反应的进行,混合气体的密度逐渐减小
C. 该温度下,反应的平衡常数K=20/3
D. 达到平衡时,B的转化率为20%
难度: 困难查看答案及解析
-
已知下列热化学方程式:
①C(s)+O2(g)==CO2(g)△H= —393.5kJ/mol
②CO(g)+ 1/2 O2(g)== CO2(g)△H= —283.0kJ/mol
③2Fe(s)+3CO(g)==Fe2O3(s)+3C(s) △H= —489.0kJ/mol
则4Fe(s)+3O2(g)==2Fe2O3(s)的反应热ΔH为
A. -1641.0kJ/mol B. +3081kJ/mol C. +663.5kJ/mol D. -2507.0kJ/mol
难度: 中等查看答案及解析
-
某温度下向20mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化)。下列说法中正确的是( )
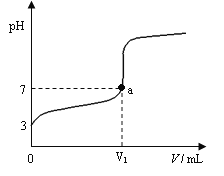
A. 该温度下醋酸的电离平衡常数约为1×10-5mol·L-1
B. 图中V1>20mL,且a点对应的溶液中:c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-)
C. 图中V1<20mL,且a点对应的溶液中:c (CH3COOH) + c (CH3COO-) <c (Na+)
D. 当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH) + c (H+) > c (OH-)
难度: 困难查看答案及解析
-
密闭容器中进行下列反应:M(g)+N(g)
R(g)+2 L,如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是
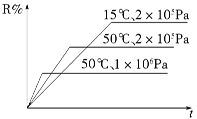
A. 正反应吸热,L为气体 B. 正反应吸热,L为固体或纯液体
C. 正反应放热,L为气体 D. 正反应放热,L为固体或纯液体
难度: 中等查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应 2A(g)+B(g)
2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1•s-1
② 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小
③ 2 s 时物质 A 的转化率为70%
④ 达到平衡状态时,增加A物质的量,A和B转化率都提高
⑤当各物质浓度满足c(A)=2c(B)= c(C)时,该反应达到了平衡状态
其中正确的是( )
A. ①③ B. ①② C. ②③ D. ③④
难度: 中等查看答案及解析