-
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF—F 、S—F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A. -1780kJ·mol-1 B. -1220 kJ·mol-1 C. -450 kJ·mol-1 D. +430 kJ·mol-1
难度: 中等查看答案及解析
-
在298K、100kPa时,已知: ①2H2O(g)=O2(g)+2H2(g) ΔH1
② Cl2(g)+H2(g)=2HCl(g) ΔH2③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
A. Δ H3=ΔH1+2ΔH2 B. Δ H3=ΔH1+ΔH2
C. Δ H3=ΔH1-2ΔH2 D. Δ H3=ΔH1-ΔH2
难度: 中等查看答案及解析
-
判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定能自发进行的是
A. ΔH<0,ΔS>0 B. ΔH>0,ΔS>0 C. ΔH<0,ΔS<0 D. ΔH>0,ΔS<0
难度: 简单查看答案及解析
-
下列变化过程,属于放热反应的是
①液态水变成水蒸气 ②酸碱中和反应 ③两份相同浓度的稀H2SO4混合
④研磨固体氢氧化钠 ⑤弱酸电离 ⑥H2在Cl2中燃烧
A. ①⑤ B. ②③④⑤ C. ②③④⑥ D. ②⑥
难度: 简单查看答案及解析
-
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是
A. 甲醇 B. 天然气 C. 氢气 D. 液化石油气
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A. C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1367.0 kJ·mol-1(燃烧热)
B. NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=+57.3 kJ·mol-1(中和热)
C. 2NO2===O2+2NO ΔH=+116.2 kJ·mol-1(反应热)
D. S(s)+O2(g)===SO2(g) ΔH=-296.8 kJ·mol-1(反应热)
难度: 简单查看答案及解析
-
已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-24.8 kJ·mol-1
②Fe2O3(s)+1/3CO(g)===2/3Fe3O4(s)+1/3CO2(g) ΔH=-15.73 kJ·mol-1
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH=+640.4 kJ·mol-1
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
A. -218 kJ·mol-1 B. -109 kJ·mol-1 C. +218 kJ·mol-1 D. +109 kJ·mol-1
难度: 简单查看答案及解析
-
已知4NH3+5O2===4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是
A. 4/5v(NH3)=v(O2) B. 5/6v(O2)=v(H2O)
C. 4/5v(O2)=v(NO) D. 2/3v(NH3)=v(H2O)
难度: 简单查看答案及解析
-
在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是
①增大反应物的浓度 ②升高温度 ③增大压强 ④加入催化剂
A. ①② B. ①③ C. ②③ D. ②④
难度: 简单查看答案及解析
-
甲烷的燃烧热ΔH=-890.3 kJ·mol-1。1 kg CH4在25 ℃、101 kPa时充分燃烧生成液态水放出的热量约为
A. 5.56×104 kJ B. 5.56×104 kJ·mol-1
C. -5.56×104 kJ·mol-1 D. -5.56×104 kJ
难度: 简单查看答案及解析
-
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
实验编号
反应物
催化剂
①
10 mL 2% H2O2溶液
无
②
无
③
10 mL 5% H2O2溶液
MnO2固体
A. 5 mL 2% H2O2溶液 B. 10 mL 2% H2O2溶液
C. 10 mL 5% H2O2溶液 D. 5 mL 10% H2O2溶液
难度: 简单查看答案及解析
-
为探究锌与0.1 mol/L稀硫酸的反应速率[以v(H2)表示],对反应物作出如下改变。下列判断正确的是
A. 加入NH4HSO4固体,v(H2)不变
B. 把稀硫酸改为98%的浓硫酸,v(H2)减小
C. 加入少量水,v(H2)增大
D. 把0.1 mol/L 稀硫酸改为0.2 mol/L盐酸,v(H2)不变
难度: 简单查看答案及解析
-
两个恒容容器中分别发生反应A(g)
2B(g)和2A(g)
C(g),平衡时A的转化率分别为α1和α2。在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A. α1减小,α2增大 B. α1、α2均增大
C. α1、α2均减小 D. α1增大,α2减小
难度: 中等查看答案及解析
-
下列有关说法正确的是
A. 某吸热反应能自发进行,因此该反应是熵增反应
B. 2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C. CaCO3(s)===CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
D. 对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大。
难度: 简单查看答案及解析
-
现有下列三个图象:下列反应中符合下述全部图象的反应是
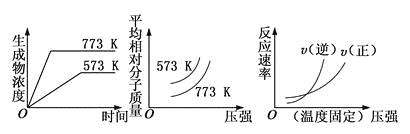
A. N2(g)+3H2(g)
2NH3(g) ΔH<0
B. 2SO3(g)
2SO2(g)+O2(g) ΔH>0
C. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
D. H2(g)+CO(g)
C(s)+H2O(g) ΔH>0
难度: 困难查看答案及解析
-
一定温度下,向一个容积为2 L的真空密闭容器中(事先装入催化剂)通入1 mol N2和3 mol H2,3 min后测得密闭容器内的压强是起始时的0.7倍,在此时间内v(H2)是
A. 0.1mol/(L·min) B. 0.2mol/(L·min)
C. 0.3mol/(L·min) D. 0.6mol/(L·min)
难度: 中等查看答案及解析