-
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
NH4+、Fe2+、SO42-
少量Ba(OH)2溶液
2NH4++SO42-+Ba2++2OH-=2NH3·H2O+BaSO4↓
B
Mg2+、Cl-、HCO3-
过量NaOH溶液
Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32-
C
K+、CO32-、NH3•H2O
通入少量CO2
2OH- +CO2=CO32-+H2O
D
Fe3+、NO3-、HSO3-
NaHSO4溶液
HSO3-+H+=SO2↑+H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
中国传统文化对人类文明贡献巨大。下列古代文献涉及的化学研究成果,对其说明合理的是
A. 《开宝本草》中记载“…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”利用溶解、蒸发、结晶
B. 《本草纲目》中“用浓酒和糟入甑,蒸令气上,用器承滴露”,利用到萃取
C. 《金石类》中记载有加热青矾( FeSO4·7H2O)分解时的景象“青矾烧之赤色,气熏人,衣服当之易烂,载木不盛。”主要发生了非氧化还反应
D. 《神农本革经》记载:“石硫磺(S)…主阴蚀疽痔恶血,坚筋骨,除头秃,能化金银铜铁奇物。”得出硫磺(S)具有的性质是还原性,作用可用于杀菌、消毒
难度: 简单查看答案及解析
-
下列各项反应对应的图象正确的是
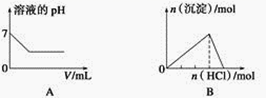
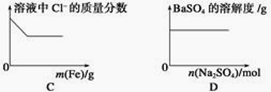
A. 25 ℃时,向亚硫酸溶液中通入氯气
B. 向NaAlO2溶液中通入HCl气体
C. 向少量氯化铁溶液中加入铁粉
D. 向BaSO4饱和溶液中加入硫酸钠
难度: 中等查看答案及解析
-
某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法正确的是
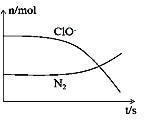
A. 该反应中Cl-为氧化产物
B. 反应后溶液的碱性减弱
C. 消耗1 mol还原剂,转移6 mol电子
D. 该反应说明非金属性Cl>N
难度: 中等查看答案及解析
-
下列关于物质的分类或变化说法正确的是
A. Na2CO3、BaCl2是常见的强电解质,且溶于水时均会破坏水的电离平衡
B. NO2经降温加压凝成无色液体为物理变化,NO2排水收集到无色气体为化学变化
C. Na2O•SiO2是一种简单的硅酸盐,露置于空气中会变质
D. 植物油可萃取溴水中的溴而使溴水褪色
难度: 简单查看答案及解析
-
溶液X中含有下表离子中的某5种,且其浓度均为0.1 mol·L−1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是
阳离子
阴离子
Na+、Fe3+、Fe2+、Mg2+
NO3-、HCO3-、CO32-、SO42-、Cl- NO3-
A. X溶液中一定含Fe3+、Fe2+
B. X溶液中不可能含有HCO3-或CO32-
C. 生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O
D. 根据电荷守恒,原溶液中一定含Mg2+
难度: 中等查看答案及解析
-
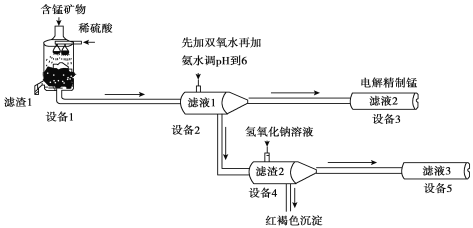
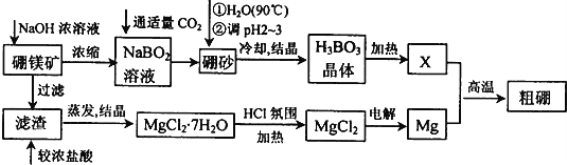
工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下,下列说法不正确的是
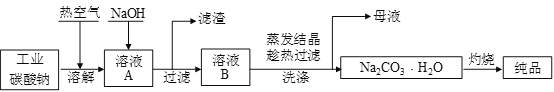
A. 步骤①,通入热空气可以将Fe2+氧化
B. 步骤②,产生滤渣的主要成分为Mg(OH)2和 Fe(OH)3
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3·H2O中混有Na2CO3·10H2O等杂质
D. 步骤④,灼烧Na2CO3·H2O在瓷坩埚中进行
难度: 中等查看答案及解析
-
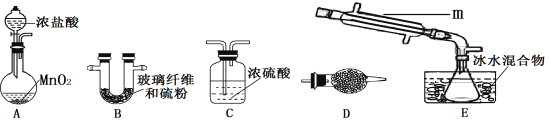
按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
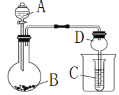
A. 若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C. 若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D. 若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 10g质量分数为46%的乙醇溶液中,氢原子的总数约为0.6NA
B. 7.8g Na2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
C. 将1L 0.1mol·L−1 FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下,NH
数目:1L 0.5mol·L−1 NH4Cl溶液大于2L 0.25mol·L−1 NH4Cl溶液
难度: 中等查看答案及解析
-
如图所示,常温时将一滴管液体Y一次性全部挤到充满O2的锥形瓶内(装置气密性良好),若锥形瓶内气体的最大物质的量是a mol,久置后其气体的物质的量是b mol,其中a≥b的是
X
Y

A
少量C、Fe屑
NaCl溶液
B
过量Na2SO3粉末
稀H2SO4
C
少量Fe块
浓H2SO4
D
过量Cu粉末
浓HNO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
中学常见的某反应的化学方程式为a+b→c+d+H2O。下列叙述不正确的是
A. 若a是Fe,b是稀硝酸(过量),a可溶于c溶液中。则a与b反应的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O
B. 若c、d均为气体,且都能使澄清石灰水变浑浊。现将混合气体通入溴水中,橙色褪去,褪色的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br-
C. 若c是无色刺激性气味的碱性气体,在标准状况下收集到含空气和c体积各半的混合气体,进行喷泉实验,假设溶质不扩散,所得溶液的物质的量浓度可能为0.022 mol·L-1
D. 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4∶5,则反应的离子方程式可以写为4CO2+5OH-═CO32-+3HCO3-+H2O
难度: 中等查看答案及解析
-
某溶液中可能含K+、Ba2+、Na+、NH4+、Cl-、SO42-、AlO2-、OH-中的几种,向其中通入CO2气体,产生沉淀的量与通入CO2的量之间的关系如图所示,下列说法正确的
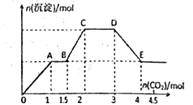
A. CD段的离子方程式可以表示为:CO32-+CO2+H2O═2HCO3-
B. 肯定不存在的离子是SO42-、OH-
C. 该溶液中能确定存在的离子是Ba2+、AlO2-、NH4+
D. OA段反应的离子方程式:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
难度: 中等查看答案及解析
-
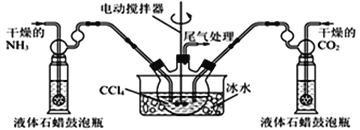
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是( )

A. A B. B C. C D. D
难度: 简单查看答案及解析
-
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol·L−1NaOH溶液,当滴加到V mL 时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中不正确的是
A. 沉淀中氢氧根的质量为(n—m)克
B. 恰好溶解后溶液中的NO3-离子的物质的量为 bv/1000mol
C. 生成标准状况下NO气体的体积为 2.24(n-m)/17L
D. 与合金反应的硝酸的物质的量为bv/1000mol+(n-m)/51mol
难度: 困难查看答案及解析