-
下列物质的水溶液因水解而呈酸性的是
A. CuCl2 B. Na2CO3 C. CH3COOH D. KHSO4
难度: 简单查看答案及解析
-
一个原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu,该反应的原电池的正确组成是( )
正极
负极
电解质溶液
A
Zn
Cu
CuCl2
B
Zn
Cu
ZnCl2
C
Cu
Zn
CuSO4
D
Cu
Zn
ZnSO4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一些食物的近似pH值如下表:
食物
苹果
葡萄
牛奶
玉米粥
pH
2.9-3.3
3.5-4.6
6.3-6.6
6.8-8.0
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用的是
A. 苹果 B. 葡萄 C. 牛奶 D. 玉米粥
难度: 简单查看答案及解析
-
下列离子方程式中.属于水解反应的是
A. CH3COOH+H2O
CH3COO-+H3O+ B. CO2+H2O
HCO3-+H+
C. HS-
S2-+H+ D. CO32-+H2O
HCO3-+OH-
难度: 简单查看答案及解析
-
下列电离方程式正确的是
A. 醋酸溶于水:CH3COOH===CH3COO-+H+
B. NaHSO4溶于水:NaHSO4===Na++HSO4—
C. 碳酸氢钠溶于水:NaHCO3
HCO3—+Na+
D. 次氯酸溶于水:HClO
H++ClO-
难度: 简单查看答案及解析
-
下列物质属于弱电解质的是( )
A. CH3COONH4 B. H2SO4 C. Na2CO3 D. CH3COOH
难度: 简单查看答案及解析
-
下列关于原电池的说法正确的是( )
A. 原电池是将电能转化为化学能的装置
B. 原电池负极发生氧化反应
C. 原电池中,阳离子向负极移动
D. 原电池电子流出的一极为正极
难度: 简单查看答案及解析
-
某弱酸溶液中存在电离平衡HA
H++A-,下列叙述不正确的是
A. 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-)
B. 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 常温下,加入NaA固体可使HA的电离常数变小
难度: 简单查看答案及解析
-
在25℃时,纯水的电离度为α1,pH=3的醋酸中水的电离度为α2,pH=11的氢氧化钠溶液中水的电离度为α3。若将上述醋酸溶液和氢氧化钠溶液等体积混合,所得溶液中水的电离度为α4,则下列关系正确的是
A. α1<α3<α2<α4 B. α3<α2<α1<α4 C. α2=α3<α1<α4 D. α2=α3<α4<α1
难度: 简单查看答案及解析
-
宇宙飞船上常使用氢氧燃料电池,其电极总反应式为:2H2+O2=2H2O;若电解质溶液为KOH溶液,则下列叙述正确的是:
A. 此电池能见到浅蓝色火焰
B. H2为正极反应活性物质
C. 工作时电解液中OH-的物质的量不断增加
D. 电极反应中: H2失电子; O2得电子
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,电解质溶液为KOH溶液,该电池能长时间保持稳定的放电电压,放电时的总反应为:3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH,下列判断不正确的是
A. 放电时,负极反应为Zn-2e-+2OH-===Zn(OH)2
B. 充电时,阴极pH增大
C. 充电时,阳极反应为Fe(OH)3+5OH-―3e-===FeO42-+4H2O
D. 放电时,每转移6mol电子,则有1 mol K2FeO4被还原
难度: 简单查看答案及解析
-
下列反应不属于水解反应的是( )
A. CO32-+H2O⇌HCO3-+OH-
B. Fe3++3HCO3--=Fe(OH)3↓+3CO2↑
C. AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
D. Al3++3AlO2-+6H2O=4Al(OH)3↓
难度: 简单查看答案及解析
-
关于金属腐蚀,下列说法正确的是
A. 金属的化学腐蚀比电化学腐蚀更普遍
B. 析氢腐蚀比吸氧腐蚀更普遍
C. 析氢腐蚀后阶段会发生吸氧腐蚀
D. 牺牲阳极的阴极保护法是利用了电解原理
难度: 中等查看答案及解析
-
氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+4OH——4e—═4H2O,2H2O+O2+4e—═4OH— . 据此判断,下列说法错误的是
A. H2在负极发生氧化反应
B. 供电时总反应为:2H2+O2═2H2O
C. 燃料电池的能量转化率为100%
D. 产物为无污染的水,属环境友好电池
难度: 中等查看答案及解析
-
如图所示,将两烧杯用导线如图相连,Pt、Cu、Zn、C分别为四个电极,当闭合开关后,以下叙述正确的是
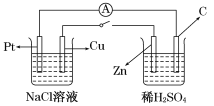
A.Cu极附近OH-浓度增大
B.Cu极为原电池负极
C.电子流向是由C极流向Pt极
D.当C极上有4 mol电子转移时,Pt极上有1 mol O2生成
难度: 简单查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
A. 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+
B. 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C. 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+
D. 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
难度: 中等查看答案及解析
-
用惰性电极电解100mLNaCl溶液,一段时间内,阴阳两极生成的气体(氢气、氯气)反应后生成的气体产物HCl恰好可中和0.01mol/L的NaOH溶液100mL,若不考虑溶液体积的变化,则此时电解液的pH为
A. 1 B. 2 C. 12 D. 13
难度: 中等查看答案及解析
