-
下列反应既是氧化还原反应,又是吸热反应的是
A. 铝片与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
下列说法或表示方法不正确的是( )
A. 盖斯定律实质上是能量守恒定律的体现
B. 在稀溶液中:H+(aq)+OH-(aq)=H2O(l);△H = –57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ
C. 由C(石墨)→C(金刚石);△H = +73 kJ/mol,可知石墨比金刚石稳定
D. 在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l);△H = –285.8kJ/mol
难度: 简单查看答案及解析
-
下列有关化学反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B. 100 mL 2 mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
难度: 中等查看答案及解析
-
下列叙述中,不能用平衡移动原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D. 黄绿色的氯水光照后颜色变浅
难度: 中等查看答案及解析
-
下列说法中有明显错误的是
A. 对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C. 活化分子之间发生的碰撞一定为有效碰撞
D. 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
难度: 中等查看答案及解析
-
在下列各说法中,正确的是
A. ΔH>0表示放热反应,ΔH<0表示吸热反应
B. 热化学方程式中的化学计量数只表示物质的量,可以是分数
C. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
难度: 中等查看答案及解析
-
下列能级中,电子能量最低的是( )
A. 1s B. 2p C. 3d D. 4f
难度: 简单查看答案及解析
-
现有下列四个图像:
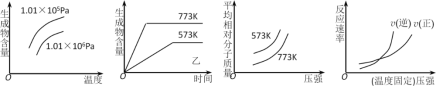
下列反应中全部符合上述图像的反应是 ( )
A. N2(g)+3H2(g)
2NH3(g) ΔH1<0
B. 2SO3(g)
2SO2(g)+O2(g) ΔH2>0
C. 4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH3<0
D. H2(g)+ CO(g)
C(s)+H2O(g) ΔH4>0
难度: 中等查看答案及解析
-
把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)
xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(L•min),下列叙述错误的是( )
A. P的平均反应速率是0.15mol/(L•min)
B. Q的转化率是25%
C. Q的平衡浓度是1mol/L
D. x的值为2
难度: 中等查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应X(g)+Y(g)
Z(g)+W(s) ΔH>0。下列叙述中,正确的是( )
A. 加入少量W,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动
D. 改变条件,又达新平衡,此时上述反应的平衡常数K值一定增大
难度: 中等查看答案及解析
-
温度为T时,向2.0L恒容密闭容器中充入1.0 molPCl5,反应PCl5(g)
PCl3(g)+Cl2(g) 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s
0
50
150
250
350
n(PCl3)/mol
0
0.16
0.19
0.20
0.20
下列说法正确的是
A. 反应在前50 s的平均速率为v (PCl3)=0.0032 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol·L-1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前v (正)>v (逆)
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
难度: 困难查看答案及解析