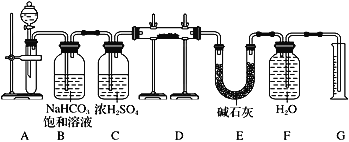
-
已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2下列关于该反应的叙述不正确的是
A. 该反应中,氧化剂与还原剂物质的量之比为 9:5
B. 当反应中有1mol电子转移时,被还原氯气物质的量为1/18 mol
C. 每产生 1mol O2时,被氧元素还原的氯气物质的量为2 mol
D. 参加反应的水有 2/5 被氧化
难度: 中等查看答案及解析
-
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
A. 滴加KI溶液时,KI被氧化,CuI是还原产物
B. 通入SO2后,溶液变无色,体现SO2的还原性
C. 整个过程发生了复分解反应和氧化还原反应
D. 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
难度: 中等查看答案及解析
-
用下列实验装置和方法进行相应实验,正确的是
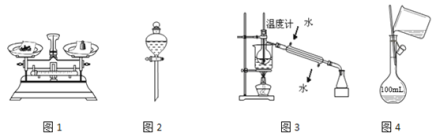
A. 用图1所示方法称量固体氢氧化钠
B. 用图2装置分离食用胡麻油与水的混合物
C. 用图3所示装置和方法进行石油分馏
D. 用图4装置配制150 mL稀盐酸
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 液态HCl 、固态NaCl均不能导电,所以HCl、NaCl是非电解质
B. NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2是电解质
C. 蔗糖、乙醇在液态时或水溶液里均不能导电,所以它们是非电解质
D. 铜、石墨均能导电,所以它们是电解质
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A. 标况下,22.4 L氧气的分子数为NA
B. 100 g质量分数为98%的浓硫酸中所含氧原子数为4NA
C. 常温常压下,42 g C2H4和C3H6的混合气体含有的H原子数为6NA
D. 18 g NH4+含有的电子数为10NA
难度: 中等查看答案及解析
-
某同学在实验室进行了如图所示的实验,下列说法中错误的是
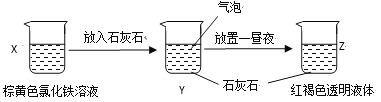
A. 利用过滤的方法,可将Z 中固体与液体分离
B. X、Z烧杯中分散质相同
C. Y 中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3(胶体)+3CO2↑+3Ca2+
D. Z 中能产生丁达尔效应
难度: 困难查看答案及解析
-
关于钠的说法正确的是
A. 4.6g钠溶于水所得溶液中.要使100个水分子溶有1个钠离子,需要水的质量是360g
B. 根据金属间置换的原理,把一小粒金属钠放入硫酸铜溶液中,可以生成金属铜
C. 当钠、钾等金属不慎着火时,可以用沙子扑灭、水浇灭等方法
D. 少量的金属钠长期暴露在空气中,它的最终产物是Na2CO3而不是NaHCO3
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 向Na2CO3溶液中逐滴加入盐酸,直到不再生成CO2气体为止,在此过程中,溶液中的HCO3-浓度变化是先变大后变小(溶液体积变化均忽略不计)
B. 向NaHCO3溶液中逐滴加入Ba(OH)2溶液,溶液中CO32-的浓度变化是先变大后变小(溶液体积变化忽略)
C. H2O2、CuS、FeCl2均不能通过单质直接化合得到
D. 将物质的量比为2:1的Na和Na2O样品分别放入等量的水中,所得溶液的质量分数分别为a%和b%,则a、b的关系是a=b
难度: 中等查看答案及解析
-
某澄清透明的溶液中,因为发生氧化还原反应而不能大量共存的离子组是
A. Na+、H+、SO42-、HCO3- B. Cu2+、K+、SO42-、NO3-
C. Fe3+、K+、I-、Cl- D. Fe3+、K+、SO42-、SCN-
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 向Mg(HCO3)2溶液中加入过量NaOH溶液,产生白色沉淀:Mg2++2HCO3-+2OH- = MgCO3↓+2H2O
B. 在强碱溶液中次氯酸钠与Fe(OH)3 反应生成Na2FeO4:3ClO-+2Fe(OH)3 =2FeO42-+3Cl-+H2O+4H+
C. NH4HCO3溶于过量的NaOH溶液中:NH4++HCO3−+2OH−=CO32−+NH3•H2O+ H2O
D. 物质的量相等的MgCl2、Ba(OH)2、 HCl三种溶液混合:Mg2++2OH-═Mg(OH)2↓
难度: 中等查看答案及解析
-
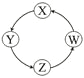
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O→Y+H2↑;Z+H2O→W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为 ( )
A. X>Y,Z>W B. X<Y,Z<W
C. X>Y,Z<W D. X<Y,Z>W
难度: 中等查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是
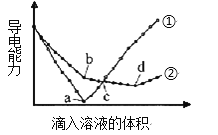
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,过滤所得滤液中滴加NaHSO4溶液,则发生的离子反应为:H++OH-=H2O
C. c点,两溶液中离子总浓度相同
D. a点对应的溶液显中性,d点对应的溶液显酸性
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+4OH- = Fe3O4↓+S4O62-+2H2O。下列说法不正确的是
A. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
B. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol
C. 每生成1 mol Fe3O4,反应转移的电子为4 mol
D. O2是氧化剂,S2O32-与Fe2+是还原剂
难度: 中等查看答案及解析
-
在密闭容器中充入CO和CO2的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内压强为P1,若控制容器的体积不变,加入足量的过氧化钠,并不断用电火花点燃至完全反应,恢复到开始的温度,再次测得容器内的压强为P2,则P1和P2关系是
A. P1=8P2 B. P1=4P2 C. P1=2P2 D. P1=P2
难度: 中等查看答案及解析
-
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
A. 2.0mol/L B. 1.5 mol/L C. 0.18 mol/L D. 0.24mol/L
难度: 困难查看答案及解析
-
下列各组物质中,满足表中图示物质在一定条件下能一步转化的全部组合是
序号
X
Y
Z
W
①
Cu
CuSO4
Cu(OH)2
CuO
②
Na
NaOH
Na2CO3
NaCl
③
C
CO
CO2
H2CO3
④
Fe
FeCl3
FeCl2
Fe(OH)2
A. ①② B. ①③④ C. ②③ D. ①④
难度: 中等查看答案及解析
-
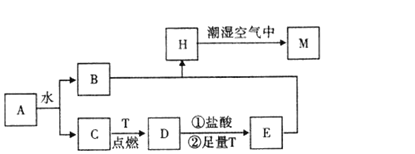
FeSO4可发生如图所示的一系列反应,下列说法错误的是

A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
难度: 中等查看答案及解析
-
由钠和氧组成的某种离子晶体含钠的质量分数是69/109,其阴离子只有过氧离子(O22-)和氧离子(O2-)两种。在此晶体中,氧离子和过氧离子的物质的量之比为
A. 2∶1 B. 1∶2 C. 1∶1 D. 1∶3
难度: 中等查看答案及解析
-
下列有关实验操作,现象和解释或结论都正确的是
操作
现象
解释或结论
A
向饱和Na2CO3 溶液中通入足量CO2
溶液变浑浊
析出了NaHCO3晶体
B
向FeCl3溶液中通入SO2
溶液黄色褪去
二氧化硫有漂白性
C
用洁净铂丝蘸取溶液进行焰色反应
火焰呈黄色
溶液中有Na+、无K+
D
向Na2CO3粉末中滴加几滴水
少量溶解
Na2CO3易溶于水
A. A B. B C. C D. D
难度: 中等查看答案及解析