-
a、b、d、e 是原子序数依次增大的短周期元素,a是周期表中原子半径最小的元素,b2-和c2+的电子层结构相同,e的核电荷数是b的2倍,元素d的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是
A. 元素b的简单气态氢化物的热稳定性比e的弱
B. 元素c的最高价氧化物对应水化物的碱性比d的强
C. 简单离子半径r:c> d> e> b
D. 元素a、b、e各自最高和最低化合价的代数和分别为0、4、4
难度: 中等查看答案及解析
-
化学与生产、生活密切相关,下列说法不正确的是
A. 合成纤维,主要是以化石燃料为原料生产 B. 太阳能、氢能等都属于新能源
C. 煤的干馏也称为煤的焦化,可得煤油 D. 电能是使用最方便的一种二次能源
难度: 简单查看答案及解析
-
下列叙述中不正确的是
A. 酸性高锰酸钾溶液可用来鉴别乙烷和乙烯
B. 烃分子中都含有极性键和非极性键
C.
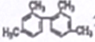 分子中至少11个碳原子处于同一平面
分子中至少11个碳原子处于同一平面D. 利用灼烧的方法可鉴别蚕丝和棉制品
难度: 中等查看答案及解析
-
下列实验现象和结论都正确的是
实验
现象
结论
A
向无色溶液中滴加稀硫酸
产生白色沉淀
溶液中一定含有Ba2+
B
向CuSO4溶液中滴加氢硫酸
产生黑色沉淀
酸性:H2S>H2SO4
C
向KSCN和酸性FeCl2溶液中滴加H2O2溶液
溶液变红色
氧化性:H2O2>Fe3+
D
向5mL0.2mo1/L NaOH溶液中滴几滴0.1 mo1/LMgCl2溶液,再滴加饱和FeCl3溶液
产生的白色沉淀 转化成红褐色
溶解度: Fe(OH)32
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
塑化剂是一种对人体有害的物质。增塑剂DCHP可由邻苯二甲酸酐与环已醇反应制得。下列说法不正确的是
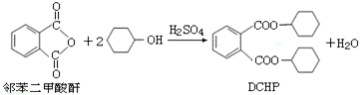
A. DCHP的分子式为C20H26O4
B. 该反应属于取代反应
C. DCHP的一氯取代产物有6种
D. 与环已醇分子式相同,且具有醛基(-CHO)的结构共有9种
难度: 中等查看答案及解析
-
双隔膜电解池(两电极均为惰性电极)的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。对该装置及其原理判断错误的是
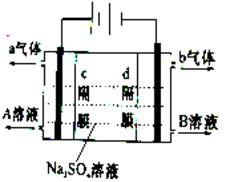
A. 如电极材料均改为铜板,电解池的总反应方程式不变
B. 向A溶液中滴加石蕊试液显红色
C. c隔膜为阴离子交换膜、d隔膜为阳离子交换膜
D. 相同条件下,c隔膜附近电极产生的a气体与d隔膜附近电极产生的b气体体积比为1:2
难度: 困难查看答案及解析
-
亚氯酸钠(NaClO2)在溶液中对生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=﹣lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是
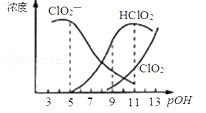
A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
难度: 困难查看答案及解析
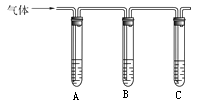
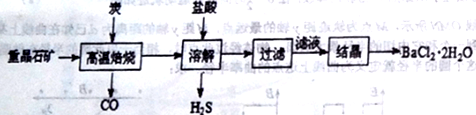
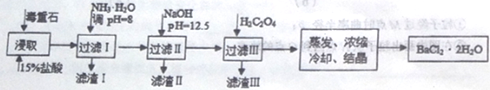

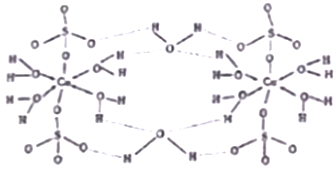


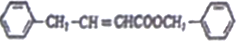 )是一种香料,它的合成路线如下:
)是一种香料,它的合成路线如下:
