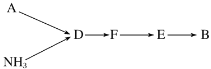-
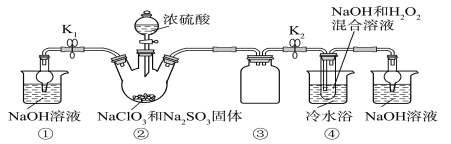
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂,干燥的高铁酸钾在198 ℃以下是稳定的,受热易分解。高铁酸钾在水处理过程中涉及的变化过程有
①蛋白质的变性 ②蛋白质的盐析 ③胶体聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A. ①②③④ B. ①③④⑥
C. ②③④⑤ D. ②③⑤⑥
难度: 简单查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法不正确的是
A. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
B. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
C. “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
D. 古剑“沈卢”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 简单查看答案及解析
-
某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5 mL 0.2 mol·L-1盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是
A. 该溶液中一定不含Ba2+、Mg2+、Al3+、SiO32-、Cl-
B. 该溶液中一定含有K+、AlO2-、CO32-、Cl-
C. 该溶液是否有K+需做焰色反应实验(透过蓝色钴玻璃片)
D. 可能含有Cl-
难度: 困难查看答案及解析
-
关于下列诗句或谚语,说法不正确的是( )
A. “忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关
B. “水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
C. “滴水石穿、绳锯木断”不包含化学变化
D. “落汤螃蟹着红袍”肯定发生了化学变化
难度: 中等查看答案及解析
-
下列化学实验基本操作错误的是
A. 熄灭酒精灯时,用灯帽盖灭,而且盖两次
B. 给试管里液体加热,液体应不超过试管容积的三分之一
C. 给试管加热时,应用手拿住试管夹的短柄
D. 试管洗涤干净后要管口向下,倒放在试管架上
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列关于物质结构的说法不正确的是
A. 12 g金刚石含有的共价键数目为2NA B. 1 mol甲醇中含有的共价键数目为5NA
C. 1 mol NH3中含有4NA对共用电子对 D. 常温常压下,8 g O2含有4NA个质子
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述中,正确的是
A. 12.0gNaHSO4晶体中阳离子和阴离子的总数为0.3 NA
B. 14g分子式CnH2n的链烃中含有的碳碳双键的数目一定为NA/n
C. 标准状况下,1L液态水中含有的H+数目为10-7NA
D. 足量Zn与一定量的浓硫酸反应,产生22.4L气体时,转移的电子数为2 NA
难度: 中等查看答案及解析
-
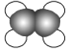
下列化学用语或模型表达正确的是( )
A. 乙烯的比例模型为
 B. Na+的结构示意图为
B. Na+的结构示意图为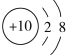
C. 葡萄糖的实验式为C6H12O6 D. CO2的电子式为
难度: 中等查看答案及解析
-
氧元素是地壳中含量最多的元素。下列说法中正确的是( )
A. 16O2与18O3互为同位素
B. 氧元素与其他短周期非金属元素均能形成酸性氧化物
C. 氧与钠形成的稳定化合物中,阴、阳离子个数比均为1∶2
D. O2变成O3以及16O变成18O的变化均属于化学变化
难度: 简单查看答案及解析
-
下列有关说法错误的是( )
A. H2O2、Na2O2都属于过氧化物、都存在非极性共价键
B. H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同
C. 双氧水是绿色氧化剂,可作医疗消毒剂
D. H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子
难度: 中等查看答案及解析
-
一定条件下,向含HNO3的废水中加入CH3OH进行污水处理,发生反应5CH3OH+6HNO3===3N2↑+5CO2↑+13H2O下列说法正确的是
A. CH3OH被氧化,表现氧化性
B. 此条件下还原性强弱为N2>CH3OH
C. 若氧化产物比还原产物多0.2 mol,则该反应中转移3 mol e-
D. 该反应过程中断裂的化学键既有极性键又有非极性键
难度: 中等查看答案及解析
-
将一定量的氯气通入30 mL浓度为10.00 mol·L-1的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+)∶n(Cl-)可能为7∶3
C. 若反应中转移的电子为n mol,则0.15<n<0.25
D. n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
难度: 简单查看答案及解析
-
下列反应中,第一步反应生成的沉淀经第二步反应后质量增加的是
A. 将少量FeCl2溶液加入到NaOH溶液中,再滴加H2O2溶液
B. 将少量AgNO3溶液滴加到NaBr溶液中,再滴加Na2S溶液
C. 将少量CO2(g)通入饱和Ca(OH)2溶液中,再通入过量Cl2(g)
D. 将少量Ba(OH)2溶液滴加到入A12(S04)3溶液中,再加入过量NaOH溶液
难度: 困难查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),下列说法正确的是
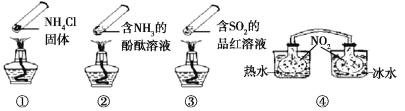
A. 加热时,①封管上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好
B. 加热时,②、③溶液均变红,冷却后又都变为无色
C. ④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅
D. 四个“封管实验”中所发生的化学反应都是可逆反应
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
B. 0.1 mol/L NH4Al(SO4)2溶液与0.2 mol/L Ba(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D. 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
难度: 中等查看答案及解析
-
下列有关实验误差分析中,不正确的是
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏低
难度: 中等查看答案及解析
-
已知A、B为单质,C为化合物,能实现上述转化关系的是( )
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A. ①② B. ①③ C. ②④ D. ③④
难度: 中等查看答案及解析
-
向含2mol NaOH、1mol Ba(OH)2、2mol NaAlO2的混合液中慢慢通入CO2至过量,下列有关说法正确的是
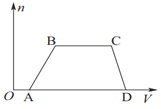
A. 整个过程中共发生四个离子反应。
B. 根据现象可判断酸性强弱为:H2CO3>HAlO2>HCO3-
C. 通入3molCO2和通入5molCO2都只产生3mol沉淀
D. 整个过程中生成沉淀的物质的量与通入CO2的体积的图象如图所示:
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )
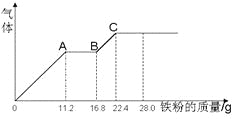
A. 混合液中NO3-的物质的量为0.2 mol
B. OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气
C. 溶液中最终溶质为FeSO4
D. c(H2SO4)为5 mol·L-1
难度: 困难查看答案及解析
-
短周期的四种非金属元素m、n、p、q原子序数依次增大,n与q为同主族元素,m和p原子最外层电子数之和等于n和q原子最外层电子数之和,p的单质在常温下能与水剧烈反应。下列说法一定正确的是
A. 原子半径:m>n B. 氢化物的稳定性:n>p
C. q的最高价氧化物的水化物为强酸 D. n在自然界中能以游离态存在
难度: 中等查看答案及解析
-
短周期元素X、Y、Z的原子序数依次增大,其中Y元素的原子半径最大。已知A、B、C分别是X、Y、Z三种元素的单质,A和C常温下为气体。在适宜的条件下, A、B、C可以发生如图所示的反应。下列说法正确的是
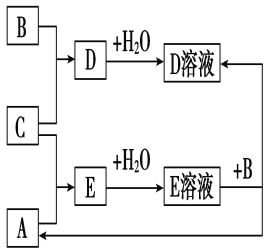
A. 化合物YX中含离子键 B. Z的含氧酸均为强酸
C. 非金属性:X>Z D. 离子半径:Y>Z
难度: 困难查看答案及解析
-
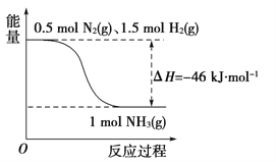
红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如图所示,图中的ΔH表示生成1 mol产物的数据。可知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是
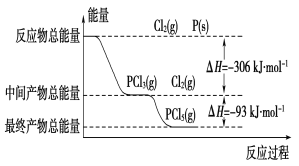
A. 其他条件不变,升高温度有利于PCl5的生成
B. 反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热 ΔH=-798 kJ·mol-1
C. P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)===2PCl3(g)ΔH=-306 kJ·mol-1
D. 其它条件不变,对于2PCl5(g)===2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
难度: 中等查看答案及解析
-
仅用下表提供的玻璃仪器(自选非玻璃仪器)就能实现相应实验目的的是
选项
实验目的
玻璃仪器
A
分离硝酸钾和氯化钠混合物
烧杯、酒精灯、玻璃棒、分液漏斗
B
配制450 mL 2 mol·L-1氯化钠溶液
500 mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管
C
用软锰矿与浓盐酸制取并收集干燥的氯气
烧瓶、酒精灯、导管
D
探究镁、铝金属的活动性顺序
胶头滴管、温度计、玻璃棒
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项
实验操作
实验现象
结 论
A
用洁净的铂丝蘸取某食盐试样在酒精灯火焰上灼烧
火焰显黄色
该食盐中不含有KIO3
B
将SO2气体通入到Ba(NO3)2溶液中
生成白色沉淀
此沉淀是BaSO3
C
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
D
在CuSO4溶液中加入KI溶液,再加入苯,振荡、静置
有白色沉淀生成,苯层呈紫色
白色沉淀可能为CuI
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是 ( )
A. 2.24g B. 3.36g C. 5.60g D. 10.08g
难度: 困难查看答案及解析
-
将9 g铜和铁的混合物投入100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入 KSCN溶液,溶液不变红,则下列说法正确的是( )
A. 原混合物中铜和铁各0.065 mol
B. 稀硝酸的物质的量浓度为4.0 mol• L-1
C. 第一次剩余的4.8 g金属为铜和铁
D. 向反应后的溶液中再加入该稀硝酸100 mL,又得到的NO在标准状况下的体积为0.56 L
难度: 困难查看答案及解析
-
有一混合溶液,其中只含有Fe2+、Cl―、Br―、I―(忽略水的电离),Cl―、Br―、I―的个数比为2:3:4,向该溶液中通入Cl2使溶液中Cl―和Br―的个数之比为3 :1,则通入Cl2 的物质的量与溶液中剩余Fe2+的物质的量之比为
A. 7:2 B. 7:1 C. 7:4 D. 7:3
难度: 困难查看答案及解析