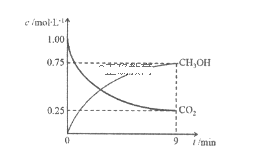
-
用c水(H+)、c水(OH- )表示由水电离产生的H+、OH-浓度。常温下四种溶液:① CH3COONH4溶液②pH=7的CH3COONa、CH3COOH混合溶液 ③pH=5且c水(H+)=10-7mol/L的HCl、NH4Cl混合溶液 ④KI溶液,其中 c水(OH- )=10-7mol/L 的是
( )
A. ①③④ B. ①②④ C. ②③④ D. ①②③④
难度: 中等查看答案及解析
-
CO、H2、C2H5OH三种物质燃烧的热化学方程式如下:
①CO(g)+1/2O2(g)═CO2(g) △H1=a kJ/mol;
②H2(g)+1/2O2(g)═H2O(g) △H2=b kJ/mol;
③C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g) △H3=c kJ/mol。
下列说法正确的是
A. △H1>0
B. 2H2O(l)═2H2(g)+O2(g) △H=-2b kJ/mol
C. CO2与H2合成C2H5OH反应的原子利用率为100%
D. 2CO(g)+4H2(g)═H2O(g)+C2H5OH(l) △H=(2a+4b-c) kJ/mol
难度: 中等查看答案及解析
-
下列有关化学反应速率的说法正确的是
A. 升高温度,可以加快反应速率,缩短可逆反应达到平衡的时间
B. 化学反应达到最大限度时,正逆反应速率也达到最大且相等
C. 增加固体反应物的量可以加快反应速率
D. 用铁片和稀硫酸反应制H2比用的浓硫酸产生H2的速率慢
难度: 简单查看答案及解析
-
常温下,Ka(HCOOH)=1.77xlO-4, Ka(CH3COOH)= Kb(NH3•H20)=1.75x 10-5,下列说法不正确的是()
A. 浓度均为0.1 mol•L-1 的HCOOH和NH3•H20溶液中:c(HCOO-)>c(NH4+)
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,HCOOH消耗NaOH溶液的体积比CH3COOH小
C. 0.1 mol• L-1CH3COOH溶液与0.1 mol• L-1NaOH溶液等体积混合后,溶液的pH=7
D. pH=7的HCOOH和NH3•H20的混合溶液中,c(HCOO—)=c(NH4+)
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 将纯水加热的过程中,Kw变大、pH变小
B. 保存FeSO4溶液时,加入稀HNO3抑制Fe2+水解
C. FeCl3溶液蒸干、灼烧至恒重,最终得到FeCl3固体
D. 向0.1mol·L-1氨水中加入少量水,pH减小,
减小
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 无色透明的溶液中:Fe3+、Mg2+、SCN-、Cl-
B. c(Fe2+)=1mol·L-1的溶液中:K+、NH4+、MnO4-、SO42-
C. c(H+)/c(OH-)=1×10-12的溶液中:K+、Na+、CO32-、NO3-
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42-、HCO3-
难度: 中等查看答案及解析
-
已知:1mol H2(g)与1mol Br2(g)完全反应生成2mol HBr(g)时放出72kJ的热量,有关物质的相关数据如下表,则表中a为
化学键
H2(g)
Br2(g)
HBr(g)
断裂1mol化学键需要吸收的能量/kJ
436
a
369
A. 404 B. 260 C. 230 D. 200
难度: 简单查看答案及解析
-
可以证明可逆反应N2+3H2
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6mol•L﹣1•min﹣1,逆反应速率v(NH3)=0.4mol•L﹣1•min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
难度: 中等查看答案及解析
-
关于0.01mol⋅L−1NaHCO3溶液,下列说法正确的是 ( )
A. 溶质水解反应:HCO3−+H2O⇌H3O++CO32-
B. 离子浓度关系:c(Na+)+c(H+)═c(OH−)+c(HCO3−)+c(CO32−)
C. 微粒浓度关系:c(Na+)═2[c(H2CO3)+c(HCO3−+c(CO32−)]
D. 微粒浓度关系:c(Na+)>c(HCO3−)>c(H2CO3)>c(CO32−)
难度: 中等查看答案及解析
-
H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.
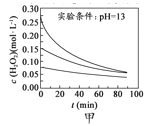 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快B.
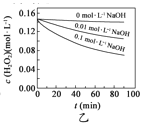 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快C.
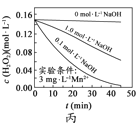 图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快D.

 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大难度: 中等查看答案及解析
-
常温下,下列有关电解质溶液叙述错误的是
A. 某H2SO4溶液中c(OH-)/c(H+)=1.0×10-8,由水电离出的c(H+)=1×10-11mol·L-1
B. 将0.02mol·L-1盐酸与0.02mol·L-1Ba(OH)2溶液等体积混合后溶液pH约为12
C. 将一定体积稀盐酸与稀氨水混合,当溶质为NH3·H2O和NH4Cl时,溶液的pH一定大于7
D. 向0.1mol·L-1Na2CO3溶液中逐滴滴加0.1mol·L-1稀盐酸,溶液中c(HCO)先增大后减小
难度: 困难查看答案及解析
-
臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是

难度: 中等查看答案及解析
-
已知: X(g)+2Y(g)
3Z(g) ΔH=-a kJ·molˉ1(a>0)。下列说法正确的是
A. 达到化学平衡状态时,Y 的正反应速率和 Z 的逆反应速率相等
B. 达到化学平衡状态时,X、Y、Z 的浓度之比为 1 : 2 : 3
C. 达到化学平衡状态时,反应放出的总热量一定小于 a kJ
D. 0.2 mol X 和 0.2 mol Y 充分反应生成 Z 的物质的量一定小于 0.3 mol
难度: 中等查看答案及解析
-
下列有关强电解质与弱电解质的叙述正确的是
A. 不同的电解质溶液,含离子越多,导电能力越强
B. 不同的电解质溶液,离子浓度越大,导电能力越强
C. 相同条件下,弱电解质溶液的导电能力一定比强电解质溶液的导电能力弱
D. 离子浓度越大,离子所带电荷越多,溶液的导电能力越强
难度: 简单查看答案及解析
-
关于化学反应中的说法错误的是( )
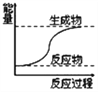
A. 需要加热的化学反应不一定是吸热反应
B. 如图可表示石灰石高温分解
C. 如图所示的反应为放热反应
D. 化学键断裂吸收能量,化学键生成放出能量
难度: 中等查看答案及解析
-
pH=2的A、B两种酸溶液各1 mL,分别加水稀释到1 000 mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是
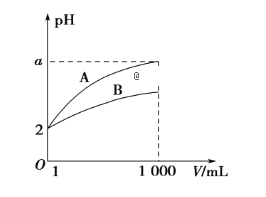
A. 稀释前,A、B两酸溶液的物质的量浓度一定相等
B. 稀释后,A酸溶液的酸性比B酸溶液强
C. a=5时,A是强酸,B是弱酸
D. 一定有关系:5>a>2
难度: 中等查看答案及解析
-
在密闭容器中,反应X2(g)+Y2(g)
2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是
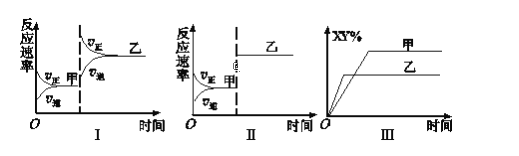
A. 图Ⅰ是加入适当催化剂的变化情况 B. 图Ⅲ是升高温度的变化情况
C. 图Ⅲ是增大压强的变化情况 D. 图Ⅱ是扩大容器体积的变化情况
难度: 中等查看答案及解析
-
在T ℃时,难溶物Ag2CrO4在水溶液中的溶解平衡曲线如下图所示,又知T ℃时AgCl的Ksp=1.8×10-10。下列说法错误的是
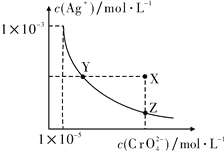
A. T ℃时,Ag2CrO4的Ksp为1×10-11
B. T ℃时,Y点和Z点的Ag2CrO4的Ksp相等
C. T ℃时 , X点的溶液不稳定,会自发转变到Z点
D. T ℃时,将0.01 mol·L-1的AgNO3溶液逐渐滴入20 mL 0.01 mol·L-1的KCl和0.01 mol·L-1的K2CrO4混合溶液中,Cl-先沉淀
难度: 中等查看答案及解析
-
下列说法正确的是
A. 用热的纯碱溶液可以清除炊具上残留的油污
B. 泡沫灭火器内的成分是苏打溶液和硫酸铝溶液
C. 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到Fe2O3
D. 将光亮Mg条放入盛有氯化铵溶液的试管中,产生的气体只有H2
难度: 中等查看答案及解析
-
已知:4NH3+5O2
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O) [mol/(L·min)]表示,则正确的关系式是( )
A. 4v(NH3)=5v(O2) B. 4v(O2)=5v(NO)
C. 2v(NH3)=3v(H2O) D. 5v(O2)=6v(H2O)
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g)
xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。现有下列几种说法:
①2 s内用物质A表示的平均反应速率为0.3 mol/(L·s);
②2 s内用物质B表示的平均反应速率为0.15 mol/(L·min)
③2 s时物质B的转化率为70%;
④x=2。
其中正确的是:
A. ①④ B. ②③ C. ①②③ D. ①②④
难度: 中等查看答案及解析
-
已知: Kb(NH3·H2O)=1.76×10-5。25℃时,分别向浓度均为0.1mol/L,体积均为20mL的HX和HY的溶液中滴入等物质的量浓度的氨水,溶液中水电离出的c水(H+)与加入氨水的体积变化关系如图所示。下列说法正确的是
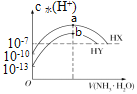
A. HX的电离方程式为HX==H++X-
B. b 点时溶液中c(NH4+)=c(Y-)>c(H+)=c(OH-)
C. 其中一种酸的电离度为0.1%
D. a点溶液呈中性
难度: 困难查看答案及解析
-
某同学研究浓度对化学平衡的影响,下列说法正确的是
已知:Cr2O72-(aq)(橙色)+H2O(l)
2 CrO42-(aq)(黄色)+2H+(aq) ∆H=+13.8kJ·mol-1
步骤:
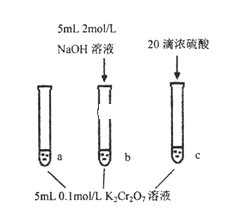
现象:
待试管b中颜色不变后与试管a比较,
溶液颜色变浅。
滴加浓硫酸,试管c温度略有升高,
溶液颜色与试管a相比,变深。
A. 该反应是一个氧化还原反应
B. 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应
C. 该实验不能证明减小生成物浓度,平衡正向移动
D. 试管c中的现象说明影响平衡的主要因素是温度
难度: 困难查看答案及解析
-
分别将下列溶液加热蒸干,仍能得到原物质的是
A. FeCl3 B. Ca(HCO3)2 C. Al2(SO4)3 D. Mg(NO3)2
难度: 中等查看答案及解析
-
25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
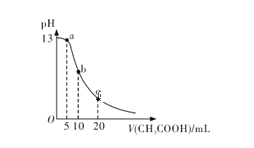
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 凡是放热反应都是自发的,吸热反应都是非自发的
B. 自发反应一定是熵增大,非自发反应一定是熵减小或不变
C. 自发反应在恰当条件下才能实现
D. 自发反应在任何条件下都能实现
难度: 中等查看答案及解析
-
下列有关沉淀溶解平衡的说法正确的是( )
A. Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B. 在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C. 在氯化银的沉淀溶解平衡体系中加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀
D. 在碳酸钙的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
难度: 简单查看答案及解析
-
合成氨反应:N2(g)+3H2(g)
2NH3(g)△H= - 92.4kJ•mol-1,在反应过程中,正反应速率的变化如图.下列说法不正确的是( )

A. t1时增大了压强
B. t2时使用了催化剂
C. t3时降低了温度
D. t4时从体系中分离出部分氨气
难度: 中等查看答案及解析