-
化学中常出现“1+1≠2”的有趣现象,但也有例外。下列符合“1+1=2”的事实是
A. 20℃,1 L水与1 L酒精混合后的体积等于2 L
B. 20℃,1 g镁与1 g稀硫酸充分反应后所得的溶液质量为2 g
C. 20℃,1 g硫粉在1 g氧气中完全燃烧后生成2 g二氧化硫
D. 20℃,1 g硝酸钾饱和溶液中加入1 g硝酸钾固体能得到2 g硝酸钾溶液
难度: 中等查看答案及解析
-
中华传统文化博大精深,下列古诗中不涉及化学变化的是
A. 飞流直下三千尺,疑是银河落九天 B. 爆竹声中一岁除,春风送暖入屠苏
C. 增火燃回春浩浩,洪炉照破夜沉沉 D. 千锤万凿出深山,烈火焚烧若等闲
难度: 简单查看答案及解析
-
下列实验操作正确的是( )
A.
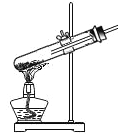 加热固体 B.
加热固体 B.  倾倒液体
倾倒液体C.
 熄灭酒精灯 D.
熄灭酒精灯 D. 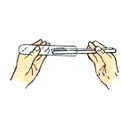 取用固体粉末
取用固体粉末难度: 简单查看答案及解析
-
空气是一种宝贵的自然资源。下列有关空气的说法不正确的是
A. 氮气的化学性质不活泼,可用于食品的防腐
B. 燃烧法测定空气中氧气的含量,不能用硫代替红磷
C. 空气的成分按质量计算,氧气大约占21%
D. 木炭在空气中燃烧,发出红光放出热量
难度: 中等查看答案及解析
-
下图为某反应的微观示意图,其中不同的球代表不同元素的原子。下列说法错误的是
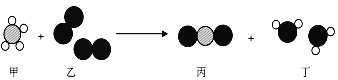
A. 乙中元素的化合价在反应前后保持不变
B. 生成物丙与丁的分子个数比为1︰2
C. 该反应一定不属于置换反应
D. 丙和丁可能都是氧化物
难度: 中等查看答案及解析
-
民间常用川乌、草乌泡制药酒。川乌、草乌含有少量有毒物质乌头碱(化学式为C34H47NO11),药酒使用不当会造成中毒。下列关于乌头碱的说法正确的是
A. 乌头碱由93个原子构成
B. 乌头碱分子相对分子质量为645
C. 乌头碱在空气中充分燃烧只生成CO2和H2O
D. 乌头碱分子中C、O元素质量比为34:11
难度: 中等查看答案及解析
-
性质决定用途,以下物质的用途与其化学性质有关的是
A. 生石灰作食品干燥剂 B. 用洗洁精清洗餐具
C. 钨用于制白炽灯灯丝 D. 干冰用于人工降雨
难度: 简单查看答案及解析
-
正确理解运用化学概念是学习化学非常重要的方面。下列说法正确的是
A. 催化剂是能改变其他物质的化学反应速率,而本身的质量和性质在化学反应前后都没有改变的物质
B. 元素是具有相同核电荷数的微粒的总称
C. 氧化物是由氧元素与另一种元素组成的化合物
D. 分子是化学变化中的最小粒子
难度: 中等查看答案及解析
-
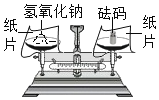
如图所示,打开止水夹,将液体A滴入试管②中与固体B 接触。若试管①中的导管口没有气泡产生,则液体A和固体B的组合可能是下列中的

A. 过氧化氢溶液和二氧化锰 B. 水和硝酸铵
C. 水和氢氧化钠 D. 稀盐酸和石灰石
难度: 中等查看答案及解析
-
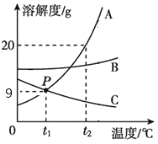
下图所示的四个图像,分别对应四种过程,其中正确的是( )

A. ①分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B. ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C. ③分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D. ④分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
难度: 困难查看答案及解析