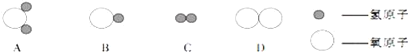-
绿色化学的核心是要利用化学原理从源头上减少和消除工业生产对环境的污染。下列措施中最符合“绿色化学”理念的是
A. 处理废弃物 B. 治理污染源 C. 深埋有毒物 D. 杜绝污染源
难度: 中等查看答案及解析
-
下列有关实验现象的描述正确的是
A. 红磷在空气中燃烧,产生大量白色烟雾
B. 用粗砂纸打磨后的铝片放入硫酸铜溶液中,一段时间后,划痕处出现红色物质
C. 铁丝在氧气中剧烈燃烧,火星四射,生成红色固体
D. 向滴有石蕊的稀盐酸中滴加氢氧化钠溶液至过量,溶液由蓝色变紫色再变红色
难度: 简单查看答案及解析
-
树立和践行“绿水青山就是金山银山”的理念。下列做法不符合该理念的是
A. 参与植树造林,扩大植被面积
B. 提倡焚烧秸秆,增加土壤肥力
C. 燃煤发电厂安装脱硫装置,减少空气污染
D. 使用新型可降解塑料,减少白色污染
难度: 简单查看答案及解析
-
材料改变了世界,材料充满生活,下列图片是生活中一些物品,其主体用到的材料属于合成材料的是
A.
 不锈钢水龙头 B.
不锈钢水龙头 B.  玻璃碗
玻璃碗C.
 电源插座外壳 D.
电源插座外壳 D.  不粘锅
不粘锅难度: 简单查看答案及解析
-
中华民族的发明创造为人类文明进步作出了巨大贡献。下列古代发明及应用中,不涉及化学变化的是( )
A.
 陶瓷烧制 B.
陶瓷烧制 B.  火药使用
火药使用C.
 粮食酿酒 D.
粮食酿酒 D.  甲骨刻字
甲骨刻字难度: 中等查看答案及解析
-
下列物质由分子构成的是
A. 石墨 B. 食盐 C. 干冰 D. 碳酸钙
难度: 简单查看答案及解析
-
下列物质的用途正确的是
A. 用浓硫酸干燥氨气 B. 用氢氧化钠溶液制叶脉书签
C. 一氧化碳用于炼钢 D. 用聚氯乙烯做食品包装袋
难度: 简单查看答案及解析
-
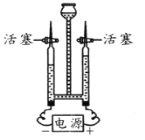
如图装置反应制取氢气,关闭活塞后固液无法分离,原因分析错误的是( )
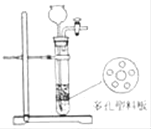
A. 装置漏气 B. 稀硫酸消耗完了
C. 固体颗粒变小掉下去了 D. 液体从长颈漏斗口溢出
难度: 简单查看答案及解析
-
下列物质显碱性的是
A. 柠檬汁 B. 雨水 C. 厨房洗涤剂 D. 食盐水
难度: 简单查看答案及解析
-
学习了化学使我们对商品标签和标识有了更深层次的认识,以下四枚标识使用不恰当的是
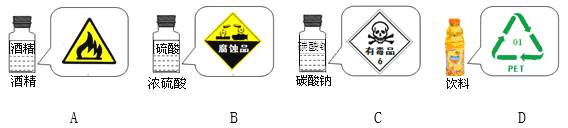
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用括号内的物质不能区分的一组是
A. NaCl固体、NH4NO3固体 (水)
B. K2CO3溶液、BaCl2溶液 (稀硫酸)
C. 铁粉、氧化铜粉末 (稀盐酸)
D. NaOH溶液、Na2CO3溶液 (酚酞)
难度: 中等查看答案及解析
-
下列反应中,属于置换反应的是( )
A. 2Al2O3
4Al+3O2↑
B. C2H5OH+3O2
2CO2+3H2O
C. 2Mg+CO2
2MgO+C
D. AgNO3+NaCl═NaNO3+AgCl↓
难度: 简单查看答案及解析
-
三氧化二铬(Cr2O3)可用作油漆颜料,Cr2O3中Cr的化合价是
A.-3 B.-2 C.+2 D.+3
难度: 中等查看答案及解析
-
维生素C,可能是我们平时最熟悉的维生素,当我们出现口腔溃疡的时候,可能就是由于缺少它引起的。其实,维生素C的作用远不止祛除口腔溃疡,我们若是睡觉之前适量的补充一些维生素C,或许能收获许多好处。维生素C的结构简式如图所示,下列有关叙述错误的是( )
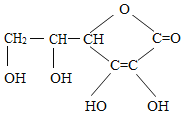
A. 维生素C的化学式为:C6H8O6
B. 维生素C的一个分子中含有20个原子核
C. 维生素 C属于有机高分子化合物
D. 维生素C中碳、氢、氧三种原子质量比为9:1:12
难度: 中等查看答案及解析
-
“微观—宏观—符号”三重表征是化学独特的表示物质及其变化的方法。如图是金属钠投入水中所发生反应的微观示意图,以下解释或说法不正确的是
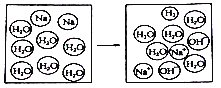
A. 参加反应的物质的微粒个数比为1︰1
B. 钠原子在该反应过程中得到电子
C. 该反应前后元素的种类没有发生变化
D. 反应后的溶液呈碱性,因为溶液中存在OH-
难度: 简单查看答案及解析
-
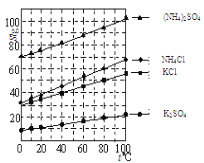
下图中,图一为四种物质的溶解度曲线,在图二中分别向两支试管内滴加一定量的水后,X和Y的饱和溶液均变混浊,则下列说法错误的是

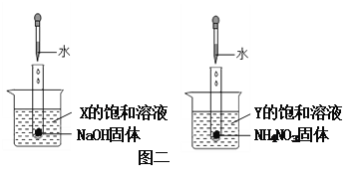
A. 10℃时,物质溶解度大小关系为:①>③>②>④
B. X为Ce2(SO4)3,Y不一定是NH4H2PO4
C. 若NHH2PO4中混有少量的NaCl杂质,可在较高温度配成饱和溶液,再降温结晶除去
D. 20℃时,将40NaCl加入到100g水中,所得溶液中溶质和溶剂的质量比是2:5
难度: 困难查看答案及解析
-
下列四个图象不能正确反映对应变化关系的是( )
A.
 向一定量的氧化铜粉末中逐渐加入稀硫酸至过量
向一定量的氧化铜粉末中逐渐加入稀硫酸至过量B.
 向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量
向等质量的镁粉和铁粉中分别逐滴加入同浓度的稀盐酸至过量C.
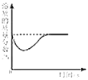 在饱和石灰水中加入少量生石灰
在饱和石灰水中加入少量生石灰D.
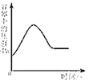 在密闭容器中用红磷测定空气中氧气的含量
在密闭容器中用红磷测定空气中氧气的含量难度: 困难查看答案及解析
-
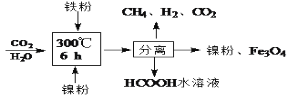
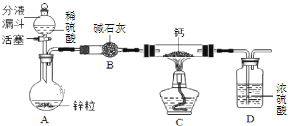
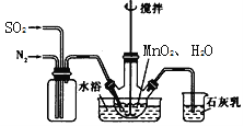
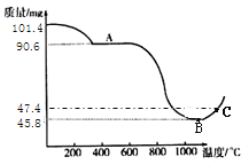
只含Fe、O两种元素的黑色固体14.4g进行如下图所示的实验,实验结束后,称得装置C质量增加了8.8g。根据实验数据分析,下列说法正确的是(假设各个反应均完全。已知FeO为黑色;CO中混有杂质CO2和H2O;碱石灰可吸收CO2和H2O)

A. 实验开始前应先点燃酒精喷灯
B. 若无A装置,黑色固体中Fe元素质量分数将偏大
C. 根据实验数据进行计算,可确定玻璃管中的黑色固体一定是FeO
D. 实验结束时关闭K1、K2,可防止B中固体被氧化
难度: 中等查看答案及解析