-
下列叙述不正确的是( )
A. 卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强
B. 以极性键结合的分子,不一定是极性分子
C. 判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称,键角小于180°,为非直线形结构
D. 非极性分子中,各原子间都应以非极性键结合
难度: 中等查看答案及解析
-
两种金属A和B,已知A,B常温下为固态,且A,B属于质软的轻金属,由A,B熔合而成的合金不可能具有的性质有( )
A. 导电、导热、延展性较纯A或纯B金属强
B. 常温下为液态
C. 硬度较大,可制造飞机
D. 有固定的熔点和沸点
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 含有非极性键的分子一定是非极性分子 B. 非极性分子中一定含有非极性键
C. 由极性键形成的双原子分子一定是极性分子 D. 键的极性与分子的极性有关
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 同一周期相邻主族的两种元素的原子序数之差是1
B. 同一主族的两种元素的原子序数之差不可能是36
C. 同一主族相邻周期的两种元素的原子序数之差可能是18
D. 同一主族相邻周期的两种元素的原子序数之差都相同
难度: 中等查看答案及解析
-
下列物质的酸性强弱比较正确的是( )
A. HBrO4<HIO4 B. H2SO4<H3PO4 C. HClO3<HClO D. H2SO4>H2SO3
难度: 简单查看答案及解析
-
在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是
A. sp,范德华力 B. sp2,范德华力
C. sp2,氢键 D. sp3,氢键
难度: 中等查看答案及解析
-
自然界中的CaF2又称萤石,是一种难溶于水的固体,属于典型的离子晶体。下列实验一定能说明CaF2是离子晶体的是( )
A. CaF2难溶于水,其水溶液的导电性极弱
B. CaF2的熔、沸点较高,硬度较大
C. CaF2固体不导电,但在熔融状态下可以导电
D. CaF2在有机溶剂(如苯)中的溶解度极小
难度: 中等查看答案及解析
-
下列分子中,所有原子的最外层均为8电子结构的是
A. BeCl2 B. H2S C. NCl3 D. SF4
难度: 简单查看答案及解析
-
氮化硼是一种新合成的结构材料,它是一种超硬、耐磨、耐高温的物质。下列各组物质熔化时所克服粒子间作用力与氮化硼熔化时克服粒子间作用力的类型都相同的是
A. 硝酸钠和金刚石 B. 晶体硅和水晶
C. 冰和干冰 D. 苯和萘
难度: 简单查看答案及解析
-
下列说法正确的是
A. 分子晶体中只存在非极性共价键
B. 稀有气体形成的晶体属于分子晶体
C. 干冰升华时,分子内共价健会发生断裂
D. 金属元素和非金属元素形成的化合物一定是离子化合物
难度: 简单查看答案及解析
-
某元素的原子核外有三个能层,最外层有4个电子,该原子核内的质子数为
A. 14 B. 15 C. 16 D. 17
难度: 简单查看答案及解析
-
下列各组表述中,两个微粒一定不属于同种元素原子的是
A. 3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B. M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C. 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D. 2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子
难度: 中等查看答案及解析
-
观察1s轨道电子云示意图,下列说法正确的是( )

A.一个小黑点表示1个自由运动的电子
B.1s轨道的电子云形状为圆形的面
C.电子在1s轨道上运动像地球围绕太阳旋转
D.1s轨道电子云的点的疏密表示电子在某一位置出现机会的多少
难度: 简单查看答案及解析
-
在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )

A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料
难度: 中等查看答案及解析
-
最近发现,只含镁、镍和碳三种元素的晶体竟然也具有超导性。鉴于这三种元素都是常见元素,从而引起广泛关注。该新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
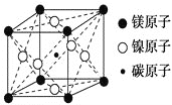
A. Mg2CNi3 B. MgC2Ni C. MgCNi2 D. MgCNi3
难度: 中等查看答案及解析
-
下列各组微粒,没有按照半径由小到大顺序排列的是
A. Cl、Na、F、K B. F、Cl、Na、K
C. Ca2+、K+、Cl-、S2- D. Na+、K+、Cl-、Br-
难度: 中等查看答案及解析
-
根据下列微粒的最外层电子排布,能确定该元素在元素周期表中位置的是
A. 4s1 B. 3d104sn C. nsnnp3n D. ns2np3
难度: 简单查看答案及解析
-
有关晶格能的叙述正确的是
A. 晶格能是原子形成1摩尔离子晶体释放的能量
B. 晶格能通常取正值,有时也取负值
C. 晶格能越大,形成的离子晶体越稳定
D. 晶格能越大,物质的硬度越小
难度: 简单查看答案及解析
-
下列基态原子的外围电子排布式中,正确的是
A. 3d94s2 B. 3d44s2 C. 4d105s0 D. 4d85s2
难度: 简单查看答案及解析
-
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
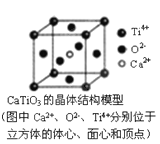
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A. ①②③⑥ B. ①②④ C. ③⑤⑦ D. ③⑤⑧
难度: 困难查看答案及解析
-
下列叙述中正确的是( )
A. 以非极性键结合起来的双原子分子一定是非极性分子
B. 以极性键结合起来的分子一定是极性分子
C. 非极性分子只能是双原子单质分子
D. 非极性分子中,一定含有非极性共价键
难度: 中等查看答案及解析
-
关于如图叙述不正确的是

A. 该种堆积方式为A3型最密堆积
B. 该种堆积方式称为A1型最密堆积
C. 该种堆积方式可用符号“…ABCABC…”表示
D. 金属Cu就属于此种最密堆积型式
难度: 简单查看答案及解析
-
下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是

A. AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B. AlF3晶体的晶格能小于NaCl晶体的晶格能
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氯化物可以形成相同类型的晶体
难度: 中等查看答案及解析
-
下列表示式中错误的是( )
A. Na+的电子式:
B. Na+的结构示意图:
C. Na的电子排布式:1s22s22p63s1
D. Na的简化电子排布式:[Ne]3s1
难度: 简单查看答案及解析
-
金属晶体中金属原子有三种常见的堆积方式,六方堆积、面心立方堆积和体心立方堆积,下图(a)、(b)、(c)分别代表这三种晶胞的结构,其晶胞内金属原子个数比为

A. 3∶2∶1 B. 11∶8∶4
C. 9∶8∶4 D. 21∶14∶9
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
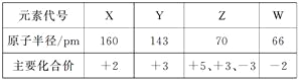
下列叙述正确的是
A. X、Y 元素的金属性X<Y
B. 一定条件下,Z单质与W的常见单质直接生成ZW2
C. Y的最高价氧化物对应的水化物能溶于稀氨水
D. 一定条件下,W单质可以将Z单质从其氢化物中置换出来
难度: 中等查看答案及解析
-
某离子化合物的晶胞结构如图所示,则该晶体中X、Y的离子个数之比是

A. 4:1 B. 1:1 C. 2:1 D. 1:2
难度: 简单查看答案及解析
-
按F、Cl、Br、I顺序递增的是
A. 最外层电子数 B. 第一电离能
C. 非金属性 D. 原子半径
难度: 简单查看答案及解析
-
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
A. 原子半径A>B>D>C B. 原子序数d>c>b>a
C. 离子半径C3->D->B+>A2+ D. 单质的还原性A>B>D>C
难度: 中等查看答案及解析
-
下列各微粒中属于等电子体的是( )
A. N2O4和NO2 B. SO2和O3 C. CO2和NO2 D. C2H6和N2H4
难度: 简单查看答案及解析