-
目前人类已发现的非金属元素除稀有气体外,共有16种,对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态;④氧化物常温下都可以与水反应生成酸。其中不正确的有( )
A. ①② B. ①③ C. ③④ D. ①②③④
难度: 中等查看答案及解析
-
根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A. K层电子为奇数的所有元素所在族的序数与该元素原子的K 层电子数相等
B. L层电子为偶数的所有主族元素所在族的序数与该元素原子L 层电子数相等
C. L层电子为奇数的所有主族元素所在族的序数与该元素原子L层电子数相等
D. M层电子为奇数的所有主族元素所在族的序数与该元素原子M层电子数相等
难度: 中等查看答案及解析
-
下列关于原子结构、元素性质的说法正确的是( )
A. 非金属元素组成的化合物中只含共价键
B. ⅠA族金属元素是同周期中金属性最强的元素
C. 同种元素的原子均有相同的质子数和中子数
D. ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
难度: 中等查看答案及解析
-
酸根RO3-所含电子数比硝酸根NO3-的电子数多10。则下列说法正确的是
A.R原子的电子层数比N的电子层数多2
B. R元素的最高正化合价与NO3-中的N的化合价相等
C. R所含电子数比N的电子数多10
D.R和N为同族元素
难度: 中等查看答案及解析
-
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是 ( )
A. 半导体材料砷化镓 B. 吸氢材料镧镍合金
C. 透明陶瓷材料硒化锌 D. 新型纳米材料氮化镓
难度: 简单查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,下列关系正确的是( )
A. 质子数:c>b B. 离子的还原性:Y2->Z-
C. 氢化物的稳定性:H2Y>HZ D. 原子半径:X<W
难度: 中等查看答案及解析
-
下列说法中,正确的是
A.HCl气体溶于水形成盐酸,存在H+,所以HCl为离子化合物
B.含金属元素的离子一定是阳离子
C.含有共价键的化合物一定是共价化合物
D.稀有气体原子之间不易形成共价键
难度: 中等查看答案及解析
-
下列说法正确的是
A. Li是最活泼金属,F是最活泼非金属
B. Mg(OH)2碱性比Ca(OH)2强
C. 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
难度: 中等查看答案及解析
-
下列根据元素周期表和元素周期律得出的推断,正确的是( )
A. 金属元素原子最外层电子数越少,该金属失电子能力越强
B. 若存在简单阴离子R2-,则R一定位于ⅥA族
C. P和As都是VA族元素,则PH3的还原性比AsH3的还原性强
D. 铅位于周期表中金属和非金属的交界处,可作半导体材料
难度: 简单查看答案及解析
-
已知溴在自然界中有两种同位素,这两种同位素原子大约各占一半,已知溴的核电荷数为35,溴元素的相对原子质量为80,则溴的这两种同位素的中子数分别为( )
A.79,81
B.44,46
C.45,46
D.44,45
难度: 中等查看答案及解析
-
放射性元素
的一个原子经过6次衰变(每次衰变都放出一个相同的粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的原子。下列说法中正确的是()
A. 每次衰变都放出
B. 每次衰变都放出T
C.
只是元素镄的一个原子,153不代表镄元素的相对原子质量
D.
经过3次这样的衰变是得不到镄原子的,产生的是Uub的同位素原子
难度: 中等查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与1 H原子组成HmX分子,在agHmX中所含质子的物质的量是( )
A. (A-N+m)mol B. (A-N)mol
C. (A-N)mol D. (A-N+m)mol
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A. 短周期中,同周期元素的离子半径从左到右逐渐减小
B. 全部由非金属元素形成的化合物中一定都是极性共价键
C. 两种原子,如果核外电子排布相同,则一定属于同种元素
D. 存在两种这样的阴、阳离子,其电子数和质子数均相同
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 元素周期表中位于金属与非金属分界线附近的元素属于过渡元素
B. 短周期第IVA族与VIIA族元素的原子间构成的分子,均满足原子最外层8电子结构
C. C、N、O、H四种元素形成的化合物一定既有离子键又有共价键
D. 第三周期非金属元素含氧酸的酸性从左到右依次增强
难度: 中等查看答案及解析
-
有M、R两种主族元素,已知M2-与R+核外电子数之和为20,则下列说法不正确的是( )
A. M与R的质子数之和一定等于19 B. M、R可能分别处于第二周期和第三周期
C. M、R可能分别处于第六主族和第一主族 D. M和R的质子数之差可能等于7
难度: 中等查看答案及解析
-
X、Y、Z、W 4种主族元素,若X的阳离子与Y的阴离子具有相同的电子层结构;W的阳离子的氧化性弱于等电荷数的X阳离子的氧化性;Z的阴离子半径小于等电荷数的Y的阴离子半径,则四种元素的原子序数由大到小的顺序是( )
A. Z X Y W B. W X Y Z C. X Y Z W D. Z Y X W
难度: 中等查看答案及解析
-
元素R的最高价含氧酸的化学式为HnRO2n-2 ,则在气态氢化物中R元素的化合价为( )
A. 12-3n B. 3n-12 C. 3n-10 D. 6-3n
难度: 中等查看答案及解析
-
下列微粒半径之比大于1的是
A. r(K+)/r(K) B. r(Ca)/r(Mg) C. r(S)/r(P) D. r(Cl)/r(Cl−)
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A. CO2的比例模型:
B. 氢氧根离子的电子式:
C. 氯原子的结构示意图:
D. 中子数为146,质子数为92的铀(U)原子
难度: 中等查看答案及解析
-
X元素的一个原子失去两个电子被两个Y元素的原子获得,从而二者形成稳定的化合物Z,下列有关Z的推断不正确的是( )
A. Z是离子化合物 B. Z的化学式是XY2
C. Z的化学式是X2Y D. Z的熔点较高,熔融状态或溶于水都能导电
难度: 简单查看答案及解析
-
甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙的阴离子发生置换反应;③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的得电子能力强的是( )
A. ④ B. ⑤ C. ①②③ D. ①②③④
难度: 中等查看答案及解析
-
A、B、C均为短周期元素,A、B同周期, A、C的最低价离子分别为A2-和C-,B2+ 和C-具有相同的电子层结构,下列说法中正确的是()
A、 C元素的最高正价为+7价 B、原子半径:A>B>C
C、离子半径:A2-> C-> B2+D、还原性:A2-<C-
难度: 简单查看答案及解析
-
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
A. 若R(OH)n为强碱,则W(OH)n+1也为强碱
B. 若HnXOm为强酸,则Y是活泼的非金属元素
C. 若Y的最低化合价为-2,则Z的最高正化合价为+7
D. 若X的最高正化合价为+5,则五种元素都是非金属元素
难度: 中等查看答案及解析
-
某反应由两步反应A
B
C构成,它的反应能量曲线如图,下列叙述正确的是
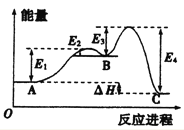
A. 两步反应均为吸热反应 B. 三种化合物中C最稳定
C. A与C的能量差为E4 D. A
B反应,反应条件一定要加热
难度: 中等查看答案及解析