-
把下列溶液蒸干并灼烧最后能得到原溶液中溶质的是
A. 氯化铁溶液 B. 碳酸钠溶液 C. 亚硫酸钠溶液 D. 高锰酸钾溶液
难度: 简单查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是
A. 纯银器表面在空气中因电化学腐蚀渐渐变暗
B. 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D. 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SO42﹣、Cl﹣
B. 由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:NO3﹣、K+、Na+、SO42﹣
C. 含有大量Fe3+的溶液中:Al3+、SCN﹣、Br﹣、Na+
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42﹣、HCO3﹣
难度: 简单查看答案及解析
-
有关AgCl沉淀的溶解平衡的说法正确的是( )
A. AgCl沉淀的生成和溶解仍在不断进行,但速率相等
B. AgCl不溶于水,溶液中没有Cl-和Ag+
C. 升高温度,AgCl的溶解度增大,Ksp不变
D. 向AgCl饱和溶液中加入NaCl固体,AgCl的溶解度和Ksp都不变
难度: 简单查看答案及解析
-
下列判断全部正确的一组是:( )
A
B
C
D
强电解质
NaCl
H2SO4
CaF2
石墨
弱电解质
HF
BaSO4
HClO
NH3·H2O
非电解质
Cl2
CS2
CCl4
蔗糖
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
物质的量浓度相同的下列各溶液,由水电离出的c(OH-)由大到小的顺序正确的是
①NaHCO3 ②NaHSO4 ③Na2SO4 ④Na2CO3
A. ①②③④ B. ④③①② C. ④①③② D. ①④③②
难度: 简单查看答案及解析
-
下列物质的水溶液因水解而呈碱性的是( )
A. NH3·H2O B. NaHCO3 C. Ba(OH)2 D. NH4Cl
难度: 简单查看答案及解析
-
下列说法中,与盐的水解无关的正确说法是( )
①明矾可以做净水剂;
②实验室配制FeCl3溶液时,往往在FeCl3溶液中加入少量的盐酸;
③用NaHCO3和Al2(SO4)3两种溶液可作泡沫灭火剂;
④在NH4Cl溶液中加入金属镁会产生氢气;
⑤草木灰与铵态氮肥不能混合施用;
⑥比较NH4Cl和Na2S等某些盐溶液的酸碱性.
A. ①④⑥ B. ②③⑤ C. ③④⑤ D. 全有关
难度: 简单查看答案及解析
-
等物质的量浓度的下列物质的溶液,其pH由小到大的顺序排列正确的是( )
①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤Al2(SO4)3
A. ①②③④⑤ B. ⑤④③②① C. ④⑤③①② D. ④⑤②①③
难度: 简单查看答案及解析
-
将a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连。若a、d相连,a为负极;c、d相连,c极产生大量气泡;b、c相连,b为正极;则这四种金属中金属性最强的是( )
A. a B. b C. c D. d
难度: 简单查看答案及解析
-
电解及其原理在化工生产中得到广泛应用,下列说法合理的是( )
A. 电镀铜时用待镀的金属制品作阳极、铜作阴极
B. AlCl3熔点低,电解熔融AlCl3冶炼铝更节能
C. 电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
D. 氯碱工业实际是指电解饱和食盐水的工业生产
难度: 简单查看答案及解析
-
准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定。 下列说法正确的是( )
A. 滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B. 随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C. 用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D. 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
难度: 中等查看答案及解析
-
下列属于水解的离子方程式且书写正确的是
A. HCO3-+H2O
H3O++CO32- B. CH3COO-+H2O
CH3COOH+OH-
C. SO32-+2H2O
H2SO3+2OH- D. Fe3++3H2O
Fe(OH)3↓+3H+
难度: 简单查看答案及解析
-
室温时,下列溶液混合后,pH大于7的是
A. 0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合
B. 0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合
C. pH=3的硫酸和pH=11的氨水等体积混合
D. pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合
难度: 简单查看答案及解析
-
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则
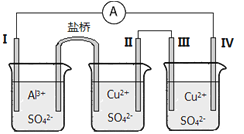
A. 电流方向:电极IV→
→电极I
B. 电极I发生还原反应
C. 电极II逐渐溶解
D. 电极III的电极反应:Cu2++2e-==Cu
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
A.NaOH(NaOH) B.CuCl2(CuO)
C.NaCl(HCl) D.CuSO4(H2O)
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A. CH2CH2 乙烯的结构简式 B. C2H6 乙烷的结构式
C.
甲基的电子式 D.
苯的化学式
难度: 简单查看答案及解析
-
有两种烃,甲为
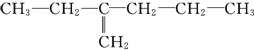 ,乙为
,乙为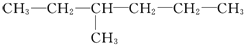 。下列有关它们命名的说法正确的是
。下列有关它们命名的说法正确的是A. 甲、乙的主链碳原子数都是6个
B. 甲、乙的主链碳原子数都是5个
C. 甲的名称为2-丙基-1-丁烯
D. 乙的名称为3-甲基己烷
难度: 简单查看答案及解析
-
对于反应H2(g)+I2(g)
2HI(g),能量变化如图所示,下列说法错误的是
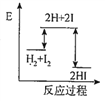
A. 该反应是放热反应 B. 升高温度平衡向逆反应方向移动
C. 增大压强,平衡不发生移动 D. 升高温度,反应的平衡常数K增大
难度: 简单查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列各图正确的是
A.
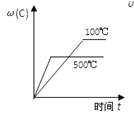 B.
B. 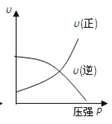 C.
C. 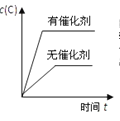 D.
D. 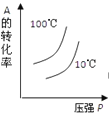
难度: 简单查看答案及解析
-
室温下向10 mL 0.1 mol/L的醋酸溶液中加水稀释后,下列说法正确的是( )
A. 溶液中导电离子的数目减小
B. 溶液中
 不变
不变C. 醋酸的电离程度增大,c(H+)亦增大
D. 醋酸的电离常数K随醋酸浓度减小而减小
难度: 简单查看答案及解析
-
25℃时,纯水中存在的平衡:H2O
H+ + OH-,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 加入稀盐酸,平衡逆向移动,c(H+)降低
C. 加入氢氧化钠溶液,平衡逆向移动,Kw变小
D. 加入少量固体CH3COONa,平衡正向移动,c(H+)降低
难度: 简单查看答案及解析