-
科学家发现两种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第二种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是
A. “四中子”不显电性
B. “四中子”的质量数为4,其质量比氢原子大
C. “零号元素”在元素周期表中与氢元素占同一位置
D. 第二种粒子的化学式为O4,与O2互为同素异形体
难度: 中等查看答案及解析
-
化学反应速率和化学反应的限度是化工生产研究的主要问题之一.下列对化学反应速率和反应限度的认识正确的是( )
A. 决定化学反应速率的主要因素是光照、超声波、压强和催化剂等
B. 化学反应速率理论是研究怎样提高原料转化率的
C. 可逆反应到一定程度时,会出现正、逆反应速率相等,各物质浓度相等的现象
D. 化学限度(即平衡)理论,是研究怎样改变反应条件,提高产品的产率
难度: 简单查看答案及解析
-
下列有关元素周期表的说法正确的是( )
A. 元素周期表有8个主族 B. 短周期是指第1、2、3周期
C. ⅠA族的元素全是金属元素 D. 0族原子的最外层电子数均为8
难度: 简单查看答案及解析
-
下列化学用语正确的是
A. Cl‑离子的结构示意图:
 B. 氯化氢的电子式为:
B. 氯化氢的电子式为:C. 甲烷的球棍模型:
 D. 含10个中子的氧原子的核素符号:
D. 含10个中子的氧原子的核素符号:O
难度: 简单查看答案及解析
-
下列各组物质,互为同分异构体的是( )
A.
与
B. O2与O3
C.
与
D.
与
难度: 简单查看答案及解析
-
元素周期表是学习化学的重要工具。下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是

A. 该元素的原子序数为6
B. 该元素所有原子的质子数均为6
C. 该元素的相对原子质量为12.01
D. 该元素没有同位素,所有原子的中子数均为6
难度: 中等查看答案及解析
-
下列分子中所有原子都满足最外层为8电子稳定结构的是( )
A. H2O2 B. CO2 C. PCl5 D. BF3
难度: 简单查看答案及解析
-
下列物质中既含离子键又含非极性共价键的是( )
A. NH4Cl B. KOH C. Na2O2 D. H2S
难度: 简单查看答案及解析
-
对于反应4NH3+5O2=4NO+6H2O,下列为四种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A. v (NH3) = 0.25 mol/(L·s) B. v (O2)= 1.4mol/(L·min)
C. v (H2O) = 0.25 mol/(L·s) D. v (NO) =9 mol/(L·min)
难度: 简单查看答案及解析
-
下列有关晶体的说法中正确的是( )
A. 晶体中分子间作用力越大,分子越稳定
B. 原子晶体中共价键越强,熔点越高
C. 冰融化时水分子中共价键发生断裂
D. 氯化钠熔化时离子键未被破坏
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 难失电子的原子,获得电子的能力一定强
B. 易得电子的原子所形成的简单阴离子,其还原性一定强
C. Be2+中的质子和电子的个数比为1:2
D. 电子层结构相同的不同离子,核电荷数越多,半径越小
难度: 简单查看答案及解析
-
下列各组中的性质比较,正确的是( )
A. 酸性HClO4>HBrO4>HIO4 B. 原子半径:H<Na<Mg<Al
C. 稳定性:HI>H2S> HCl D. 氧化性:Na+>Mg2+>Al3+
难度: 简单查看答案及解析
-
下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤氯化钠熔化时离子键被破坏
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定.
A. ①②③⑥ B. ①②④ C. ③⑤⑥ D. ③⑤
难度: 中等查看答案及解析
-
2006年俄美两国科学家共同宣布发现了第118号元素,已知第118号元素位于周期表的第七周期0族,预测第114号元素的下列叙述中,错误的是
A. 位于周期表的第七周期第ⅣA族 B. 肯定是非金属元素
C. 原子的最外层有4个电子 D. 常见的化合价有+2和+4价
难度: 中等查看答案及解析
-
下列事实可以说明M的非金属性强于N的是( )
A. 单质与氢气化合的难易程度:M易于N
B. 最高价氧化物对应水化物的酸性:M弱于N
C. 简单阴离子的还原性:M强于N
D. N的单质能从含M的简单阴离子的溶液中置换出M单质
难度: 中等查看答案及解析
-
下列关于化学反应速率的叙述不正确的是( )
A. 食物放在冰箱中会减慢变质的速率
B. 实验室制备CO2时,可通过升高温度来加快反应速率
C. 实验室用铁片和稀硫酸制备H2时,选用98% H2SO4能加快反应速率
D. 实验室制取H2时,常用锌粒代替锌粉以降低反应的速率
难度: 简单查看答案及解析
-
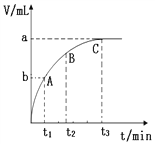
在密闭容器中进行反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A. Z为0.3 mol·L-1 B. Y2为0.4 mol·L-1
C. X2为0.2 mol·L-1 D. Z为0.4 mol·L-1
难度: 中等查看答案及解析
-
一定条件下在一容积恒为2L的容器内发生反应:2A(g)+B(g)
2C(g),已知起始投入4mol A(g) 和2mol B(g),经2s后测得C的浓度为0.6mol/L,并且2s后各组分浓度不再改变.下列说法正确的是( )
A. 2s内用物质A表示的平均反应速率为0.6mol/(L•s)
B. 2s内用物质B表示的平均反应速率为0.6mol/(L•s)
C. 2s后每有0.6mol的物质B生成,同时就有0.6mol物质C生成
D. 2s时物质B的浓度为0.7mol/L
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期主族元素。Y、Z同周期且相邻,X、W同主族且与Y处于不同周期,Y、Z原子的电子数总和与X、W原子的电子数总和之比为5:4。下列说法正确的是( )
A. 原子半径:r(W)>r(z)>r(Y)>r(x)
B. Y的简单气态氢化物的热稳定性比Z的强
C. 由X、Z组成的化合物与由Z、W组成的化合物只能发生化合反应
D. 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐
难度: 困难查看答案及解析