-
SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为( )
A. -1220 kJ/mol B. -1780 kJ/mol
C. -450 kJ/mol D. +430 kJ/mol
难度: 中等查看答案及解析
-
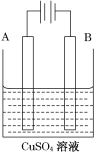
在电解水制取H2和O2时,为了增强导电性,常常要加入一些电解质,最好选用( )
A. NaOH B. HC1 C. NaCl D. CuSO4
难度: 简单查看答案及解析
-
在锌和稀硫酸制氢气的反应中,要使反应速率加快应采取的措施是( )
A. 加入少量硫酸钠溶液 B. 加入少量氯化锌溶液
C. 把纯锌换成有杂质的锌 D. 把稀硫酸换成浓硫酸
难度: 中等查看答案及解析
-
如图所示a、b都是惰性电极,通电一段时间后,a极附近溶液显红色。下列说法中正确的是( )
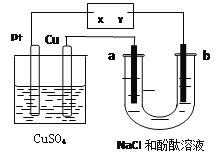
A. X是正极,Y是负极 B. U型管中溶液PH值逐渐变小
C. CuSO4溶液的pH逐渐减小 D. CuSO4溶液的pH保持不变
难度: 简单查看答案及解析
-
分析下列反应在任何温度下均能自发进行的是(
A. 2N2(g)+O2(g)=2N2O(g) △H = +163 kJ•mol-1
B. H2O2(l)=1/2O2(g)+H2O(l) △H =-98 kJ•mol-1
C. HgO(s)=Hg(l)+1/2O2(g) △H =+91 kJ•mol-1
D. Ag(s)+1/2Cl2(g)=AgCl(s) △H =-127 kJ•mol-1
难度: 中等查看答案及解析
-
在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)
2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
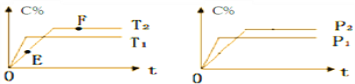
A. E点的v(逆)大于F点的v(正)
B. 若在F点时给容器加压,达新平衡时C的浓度将增大
C. 若给容器加热,该反应的平衡常数K将增大
D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变
难度: 中等查看答案及解析
-
下列关于化学平衡常数的说法中,正确的是( )
A. 在任何条件下,化学平衡常数都是一个定值
B. 化学平衡常数K可以推断一个可逆反应进行的程度
C. 化学平衡常数K只与温度、反应物浓度、体系的压强有关
D. 当改变反应物的浓度时,化学平衡常数会发生改变
难度: 中等查看答案及解析