-
W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是
A. X与其他三种元素均可形成两种或两种以上的二元化合物
B. Y与其他三种元素分别形成的化合物中只含有离子键
C. 四种元素的简单离子具有相同的电子层结构
D. W的氧化物对应的水化物均为强酸
难度: 中等查看答案及解析
-
常温下列各组离子在指定溶液中能大量共存的是( )
A. 无色透明的溶液中:Fe3+、Mg2+、SCN—、Cl—
B. c(H+)/c(OH﹣) =1×10—12的溶液中:K+、Na+、CO32—、NO3—
C. c(Fe2+)=1 mol•L—1的溶液中:K+、NH4+、MnO4﹣、SO42—
D. 能使甲基橙变红的溶液中:Na+、NH4+、SO42﹣、HCO3—
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A. 已知甲烷的燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=890.3 kJ/mol
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知中和热为ΔH=-57.3 kJ/mol,则1 mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D. 已知S(g)+O2(g)=SO2(g) ΔH1;S(s)+O2(g)=SO2(g) ΔH2,则ΔH1<ΔH2
难度: 中等查看答案及解析
-
关于一些重要的化学概念有下列说法,其中正确的是
①Fe(OH)3胶体和CuSO4溶液都是混合物
②BaSO4是一种难溶于水的强电解质
③冰醋酸、纯碱、小苏打分别属于酸、碱、盐
④煤的干馏、煤的汽化和液化都属于化学变化
A. ①② B. ①②④ C. ②③④ D. ③④
难度: 中等查看答案及解析
-
下列应用不涉及物质氧化性或还原性的是
A. 用葡萄糖制镜或保温瓶胆 B. 用ClO2杀菌、消毒
C. 用Na2SiO3溶液制备木材防火剂 D. 用浸泡过高锰酸钾溶液的硅藻土保鲜水果
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法不正确的是
A. 1LpH=3的盐酸与1LPH=3的CH3COOH溶液中,水电离出的H+数目均为10-11NA
B. 0.1mol乙烯与乙醇的混合物中含碳原子数为0.2 NA
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.1NA
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数小于0.2mol
难度: 中等查看答案及解析
-
正确表示下列反应离子方程式是
A. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C. 硫酸铵溶液和氢氧化钡溶液反应:Ba2++2OH-+2NH4++SO42-=BaSO4↓+2 NH3·H2O
D. FeCl2溶液中加入稀硝酸: 4H++NO3-+Fe2+=Fe3++NO↑+2H2O
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 常温下1molCl2和足量氢氧化钠溶液充分反应,转移电子数目为2NA
C. 64 g SO2含有氧原子数为2NA
D. 标准状况下,22.4L H2O含有的分子数为NA
难度: 中等查看答案及解析
-
下列有关铁、铝及其化合物的说法中不正确的是( )
A. 工业上在高温下用CO还原含Fe2O3的铁矿石炼铁
B. 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4
C. 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用
D. 氯化铁溶液有较强氧化性,故可用作净水剂
难度: 中等查看答案及解析
-
三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,可由氨气和氟气反应得到:4NH3+3F2 = NF3+3NH4F。在潮湿的空气中,NF3能与水蒸气发生氧化还原反应,其反应的产物有HF、NO和HNO3。下列说法正确的是
A. 制取NF3的反应中,氧化剂与还原剂的物质的量之比为3∶1
B. 在NF3与H2O的反应中,H2O作还原剂
C. 若在制取NF3的反应中有0.5 mol NH3参加反应,转移电子的物质的量为3 mol
D. NF3在空气中一旦泄漏,不易于发现
难度: 困难查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
测定醋酸钠溶液pH
用玻璃棒蘸取溶液,点在湿润的pH试纸上
测定醋酸钠溶液pH
B
向盐酸中滴入少量NaAlO2溶液
无明显现象
AlO2-与H+未发生反应
C
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
该溶液一定是钠盐溶液
D
蘸有浓氨水的玻璃棒靠近某溶液
有白烟产生
该溶液可能是浓盐酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32-、SO32-、CO32-、SO42-中的若干种离子。某同学对该溶液进行了如下实验。则下列判断正确的是
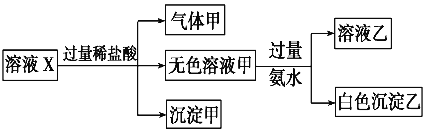
A. 气体甲一定是纯净物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO2-和SiO32-一定存在于溶液X中
D. CO32-和SO42-一定不存在于溶液X中
难度: 中等查看答案及解析
-
对实验Ⅰ~Ⅳ的实验现象预测正确的是

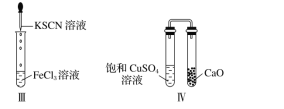
A. 实验Ⅰ:液体分层,下层呈无色
B. 实验Ⅱ:烧杯中先出现白色沉淀,后溶解
C. 实验Ⅲ:试管中有红色沉淀生成
D. 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体
难度: 中等查看答案及解析
-
完成下列实验,所选装置正确的是
A
B
C
D
实验目的
检查装置气密性
实验室用纯碱和稀硫酸制备二氧化碳
用已知浓度的氢氧化钠溶液测定未知浓度盐酸
选择合适的试剂,可分别制取少量CO2、NO和O2
实验
装置
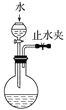
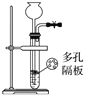

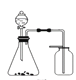
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
恒温、恒压下,将1mol O2和2mol SO2气体充入一体积可变的容器中(状态Ⅰ),发生反应2SO2+O2
2SO3,状态Ⅱ时达平衡,则O2的转化率为( )
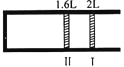
A. 40% B. 60% C. 80% D. 90%
难度: 简单查看答案及解析
-
在一定温度下的恒压容器中,进行可逆反应A(g)+B(g)⇌C(g)+2D(g);下列能说明该反应达到平衡状态的是
①反应混合物的密度不再改变 ②混合气体的平均相对分子质量不再改变
③C和D的物质的量之比为1:2 ④体系压强不再改变
⑤C的质量分数不再改变 ⑥v(A):v(C)=1:1.
A. ①②④⑤ B. ①②⑤ C. ②⑤⑥ D. ①②③④⑤⑥
难度: 简单查看答案及解析
-
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )


A. 该反应的热化学方程式为X(g)+3Y(g)
2Z(g) ΔH>0
B. 若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率增大
C. 温度分别为T1和T2时的平衡常数大小关系为K2>K1
D. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
难度: 中等查看答案及解析
-
100 ℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,Ⅰ容器0.1mol N2O4 Ⅱ容器0.2 mol NO2,发生反应:2NO2(g)
N2O4(g) ΔH<0,下列说法正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应物的转化率α(N2O4) +α(NO2)=1
B. 平衡后,再向Ⅱ容器内通入一定量的NO2,又达到平衡时,NO2的体积分数增大
C. 若只改变一个条件使Ⅱ容器NO2的平衡转化率增大,则该反应的化学平衡常数一定变大
D. 平衡后,反应放出或吸收热量的数值Q:Q(Ⅰ) =Q(Ⅱ)
难度: 中等查看答案及解析
-
下列有关水电离情况的说法正确的是
A. 25℃,pH=12 的烧碱溶液与纯碱溶液,水的电离程度相同
B. 其它条件不变,CH3COOH溶液在加水稀释过程中,c(OH-)/c(H+)一定变小
C. 其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D. 其它条件不变,温度升高,水的电离程度增大,Kw 增大
难度: 中等查看答案及解析
-
室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
难度: 中等查看答案及解析
-
一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以该分解反应ΔH<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
难度: 中等查看答案及解析
-
已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸的电离常数约为1×10-7
D. 稀释HA溶液时,不是所有粒子浓度都一定会减小
难度: 简单查看答案及解析
-
部分弱电解质的电离常数如下表:
弱电解质
HCOOH
HCN
H2CO3
电离常数(25 ℃)
Ka=1.8×10-4
Ka=4.9×10-10
Ka1=4.3×10-7 Ka2=5.6×10-11
下列说法错误的是( )
A. 结合H+的能力:CO32->CN->HCO3->HCOO-
B. 2CN-+H2O+CO2=2HCN+CO32-
C. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D. 25 ℃时,反应HCOOH + CN-
HCN+ HCOO-的化学平衡常数3.67×105
难度: 困难查看答案及解析
-
下列四种溶液:①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,正确的是
A. 由水电离的c(H+):①=②>③=④
B. 将②、③两种溶液混合后,若pH=7,则消耗溶液的体积:③>②
C. 等体积的①、②溶液分别与足量铝粉反应,生成H2的速率:①>②
D. 向等体积的四种溶液中分别加入100 mL水后,溶液的pH:③>④>①>②
难度: 中等查看答案及解析
-
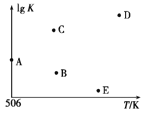
在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
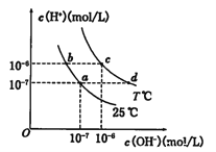
A. 向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-)
B. 25℃时,加入CH3COONa可能引起由c向d的变化,升温可能引起a向c的变化
C. T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D. b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
难度: 中等查看答案及解析
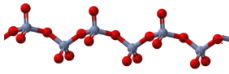
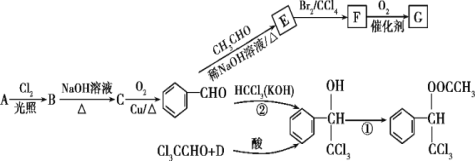
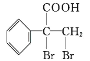 是一种重要的药物中间体,其合成路线与G相似,请以
是一种重要的药物中间体,其合成路线与G相似,请以