-
下列实验方法能达到实验目的的是
A. 用NaOH溶液除去SiO2中混有的Al2O3杂质,然后过滤
B. CO2中混有CO杂质,将其通过足量的CuO粉末,加热
C. 用NaOH溶液除去乙酸乙酯中混有的乙酸,然后分液
D. CO中混有的HCl杂质,将其通入饱和Na2CO3溶液,洗气法除去
难度: 中等查看答案及解析
-
漂白粉的使用原理:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,该反应属于
A. 分解反应 B. 复分解反应 C. 化合反应 D. 置换反应
难度: 简单查看答案及解析
-
当一束光通过鸡蛋清可以观察到丁达尔现象,这表明鸡蛋清属于
A. 溶液 B. 悬浊液 C. 胶体 D. 乳浊液
难度: 简单查看答案及解析
-
第三届联合国环境大会的主题为“迈向无污染的地球”。下列做法不应提倡的是
A. 推广电动汽车,践行绿色交通 B. 改变生活方式,预防废物生成
C. 回收电子垃圾,集中填埋处理 D. 弘扬生态文化,建设绿水青山
难度: 简单查看答案及解析
-
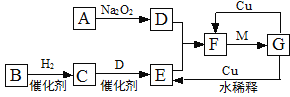
美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如下图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。 “纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与金刚石互为同分异构体
难度: 简单查看答案及解析
-
U是核电站的主要燃料,下列关于
U的说法正确的是
A. 质子数为235 B. 中子数为92 C. 电子数为143 D. 质量数为235
难度: 简单查看答案及解析
-
漂白粉的有效成分是
A. HClO B. NaClO C. Ca(ClO)2 D. CaCl2
难度: 简单查看答案及解析
-
下列物质中,属于非电解质的是
A. 酒精 B. Cl2 C. NaOH D. H2SO4
难度: 中等查看答案及解析
-
下列化学用语正确的是
A. 纯碱的化学式: NaOH B. 乙烯的结构简式:CH2CH2
C. 质子数为6、中字数为8的原子:86C D. 蔗糖的分子式C12H22O11
难度: 中等查看答案及解析
-
下列装置所示的实验中,能达到实验目的的是
A. 分离碘酒中的碘和酒精
B. 实验室制氨气
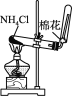
C. 除去Cl2中的HCl
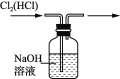 D. 排水集气法收集NO
D. 排水集气法收集NO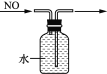
难度: 中等查看答案及解析
-
下列关于物质的叙述中不正确的是( )
A. 浓硫酸具有脱水性,可用来干燥HCl
B. 少量金属钠着火时,可用细沙覆盖灭火
C. 食盐是氯碱工业的基础原料
D. 碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一
难度: 中等查看答案及解析
-
下列实验方法不能达到实验目的的是( )
A. 用丁达尔效应区分氢氧化铁胶体与氯化铁溶液
B. 用氯化钙溶液鉴别NaHCO3和Na2CO3
C. 用分液法分离植物油和水的混合物
D. 用淀粉溶液区别加碘盐和无碘盐
难度: 中等查看答案及解析
-
下列物质的变化,不能通过一步化学反应完成的是
A. Cu→CuSO4 B. SiO2→H2SiO3 C. Cl2→HClO D. NO2→HNO3
难度: 中等查看答案及解析
-
下列金属冶炼的化学反应原理,错误的是
A. 2NaCl(熔融)
2Na+Cl2↑ B. MgO + H2
Mg+H2O
C. Fe3O4+ 4CO
3Fe+4CO2 D. 2Al2O3(熔融)
4Al+3O2↑
难度: 简单查看答案及解析
-
某无色溶液中含有大量Ba2+、H+、NO3—,该溶液中还可能大量存在的离子是( )
A. Cu2+ B. CH3COO- C. HCO
D. NH
难度: 简单查看答案及解析
-
下列对某未知溶液中离子的检验方法及其结论一定正确的是 ( )
A. 加入稀盐酸产生无色气体,一定含有CO32ˉ
B. 加入氯化钡溶液产生白色沉淀,一定含有SO42ˉ
C. 加入碳酸钠溶液产生白色沉淀,一定含有Ca2+
D. 取溶液进行焰色反应显黄色,一定含有Na+
难度: 中等查看答案及解析
-
下列离子在溶液中能大量共存的是
A. Na+、Mg2+、I—、Fe3+ B. Na+ 、K+ 、HCO3ˉ、OH—
C. NH4+、H+、NO3—、HCO3— D. K+ 、Al3+、SO42— 、NH4+
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列判断正确的是( )
A. 标准状况下,22.4 L H2O含有的分子数为NA
B. 1 mol·L-1 NaCl溶液中含有的Cl-数目为NA
C. 28 g N2和N4组成的混合气体中含有的原子数为2NA
D. 2.4 g Mg与足量盐酸反应,转移的电子数目为0.1NA
难度: 中等查看答案及解析
-
工业上利用反应 3Cl2+2NH3=N2+6HCl 检查氯气管道是否漏气。下列说法错误的是
A. 若管道漏气遇氨就会产生白烟
B. 该反应中Cl2是氧化剂
C. 该反应中N2是还原产物
D. 该反应生成1molN2有6mol电子转移
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 盐酸与氨水反应:H++OH-=H2O
B. 氯化铝溶液中加入过量氨水:Al3+ + 3NH3•H2O = Al(OH)3↓+ 3NH4+
C. Cl2与H2O的反应:Cl2+ H2O=2H++ Cl-+ClO-
D. 碳酸钙溶液与足量稀盐酸的反应:CO32-+2H+=H2O+CO2↑
难度: 中等查看答案及解析
-
除去下列物质中的杂质(括号内是杂质),能采用加入过量NaOH溶液充分反应再过滤的方法的是
A. Fe2O3(Al2O3) B. KCl(NaCl) C. SiO2(CaCO3) D. FeCl2溶液(FeCl3)
难度: 中等查看答案及解析
-
下列元素在一定条件下,能实现“
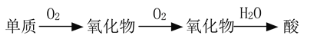 ”直接转化的元素是
”直接转化的元素是A. 硅 B. 铝 C. 铁 D. 硫
难度: 中等查看答案及解析
-
将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:
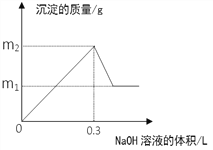
A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
难度: 困难查看答案及解析