-
下列说法正确的是
A. 金属钛性能非常优越,广泛应用于医疗及日常用品中。
B. 铜盐溶液都有毒。
C. 稀土金属被称为冶金工业的维生素,80%分布在南非等非洲国家。
D. 由于金属铝常温下不与氧气反应,所以保存铝时不需要隔绝空气。
难度: 简单查看答案及解析
-
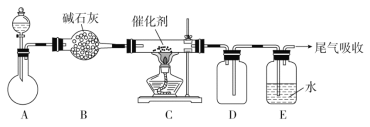
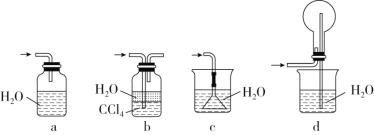
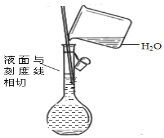
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是
A. 配制溶液
 B. 制取收集干燥氨气
B. 制取收集干燥氨气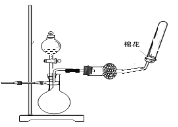
C. 除去粗盐中的不溶物
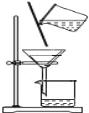 D. 观察Fe(OH)2的生成
D. 观察Fe(OH)2的生成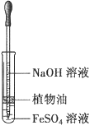
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 1 mol Fe与1 mol Cl2充分反应生成FeCl3时,转移电子数为3NA
B. 通常状况下,11.2 LH2所含的氢原子数为NA
C. 1 mol羟基与17 g NH3所含电子数之比为9∶10
D. 一定温度下,1 L 0.5 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液含NH
的物质的量相同
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增大。X原子的次外层电子数为a,最外层电子数为b;Y原子的L层电子数为(a+b),M层电子数为(b-a);W、Z原子的最外层电子数分别为(b-1)和b。下列有关说法一定正确的是
A. 气态氢化物的稳定性:X<Y B. 氧化物的水化物的酸性:W<Z
C. 原子半径:W>Z D. X与Y形成的化合物常温下不能与盐酸反应
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+===SO2↑+H2O
B. 向氨水中加入少量H2C2O4溶液:H2C2O4 +2NH3·H2O
C2O4 2—+2NH
+2H2O
C. 氢氧化钠溶液中加入铝粉:2Al+2OH- +6H2O === 2Al(OH)4-+3H2↑
D. 向CuSO4溶液中加入Na2O2:2Na2O2+2H2O===4Na++4OH-+O2↑
难度: 中等查看答案及解析
-
如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上
没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是

选项
X
Y
A
MgSO4
CuSO4
B
AgNO3
Pb(NO3)2
C
FeSO4
Al2 (SO4)3
D
CuSO4
AgNO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
分别加热Na2CO3和NaHCO3固体
试管内壁均有水珠
两种物质均受热分解
B
向稀的偏铝酸钠溶液滴加饱和氯水
生成白色沉淀
偏铝酸钠具有还原性
C
向含I﹣的无色溶液中滴加少量新制氯水,再滴加淀粉溶液
加入淀粉后溶液变成蓝色
氧化性:Cl2>I2
D
向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液
加入H2O2后溶液变成血红色
Fe2+既有氧化性又有还原性
A. A B. B C. C D. D
难度: 中等查看答案及解析