-
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A. 原子半径:r(X) < r(Y) < r(Z) < r(W)
B. W的最高价氧化物的水化物是一种弱碱
C. Y的单质的氧化性比Z的强
D. X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
按照阿伏加德罗定律,下列叙述不正确的
A. 同温同压下两种气体的体积之比等于物质的量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种气体的密度之比等于摩尔质量之比
D. 同温同体积下两种气体的物质的量之比等于压强之比
难度: 中等查看答案及解析
-
战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”。蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得。“蜃”的主要成分是
A. CaO B. NaHCO3 C. SiO2 D. CaCO3
难度: 简单查看答案及解析
-
化学来源于生活,下列有关常识说法错误的是
A. 用灼烧法可以区分蚕丝和人造皮革
B. 生活垃圾直接焚烧会产生二噁英等有害物质
C. 无水乙醇既可作燃料,也可用于杀菌、消毒
D. 加热能杀死流感病毒是因为蛋白质受热变性
难度: 简单查看答案及解析
-
下列物质的性质与应用关系不正确的是
A. 常温下,铁在浓硫酸中发生钝化,可用铁槽车贮运浓硫酸
B. MgO、Al2O3 的熔点很高,可用做耐高温材料
C. Si具有良好的导光性,可用来制作光导纤维
D. 硫磺香皂有杀菌灭虫的效果,是因为添加的硫单质有杀菌灭虫的效果
难度: 简单查看答案及解析
-
下列说法正确的是
A. 某试样焰色反应呈黄色,则试样中含有K+
B. 用广泛pH试纸测得NaClO溶液的pH值为12
C. 可用酒精代替CCl4萃取碘水中的碘单质
D. 金属镁失火不可用水来灭火
难度: 简单查看答案及解析
-
下列实验合理的是( )

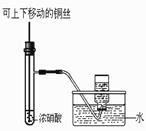
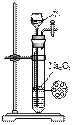
A、配制一定浓度硫酸
B、制备少量氨气
C、制备并收集少量NO2气体
D、制备少量氧气
难度: 中等查看答案及解析
-
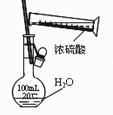
用浓硫酸配制稀硫酸时,不必要的个人安全防护用品是
A. 实验服 B. 橡胶手套 C. 护目镜 D. 防毒面罩
难度: 简单查看答案及解析
-
下列过程与氧化还原反应无关的是
A. 植物的光合作用 B. 钢铁生锈
C. 米饭变馊 D. SO2使品红溶液褪色
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 向碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B. 二氧化硫通入氯化钡溶液中:SO2+Ba2++H2O=BaSO3↓+2H+
C. 将铜片投入氯化铁溶液:Fe3++Cu=Fe2++Cu2+
D. 84消毒液(含NaClO)与洁厕灵(含 HCl)混用,会产生氯气:2H++Cl-+ ClO-=Cl2↑+ H2O
难度: 困难查看答案及解析
-
下列说法正确的是
A. 铅蓄电池在放电过程中,负极质量减小,正极质量增加
B. SO3与Ba(NO3)2溶液可得到BaSO4,SO2与Ba(NO3)2溶液可得到BaSO3
C. 明矾水解生成Al(OH) 3胶体,可用作净水剂
D. 室温下,SiO2(s)+3C(s)=SiC(s)+2CO(g)不能自发进行,则该反应的ΔH<0
难度: 困难查看答案及解析
-
下列实验对应的现象以及结论均正确的是
选项
实验
现象
结论
A
向装有溴水的分液漏斗中加入裂化汽油,充分振荡,静置
下层为橙色
裂化汽油可萃取溴
B
向Ba(ClO)2溶液中通入SO2
有白色沉淀生成
酸性:H2SO3>HClO
C
向盛有浓硫酸的试管中加入铜片,将产生的气体通入品红溶液
无明显现象
铜片未打磨
D
将一小块钠加入盛有无水乙醇的烧杯中
有气泡产生,收集气体,点燃产生爆鸣声
生成的气体是H2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列物质提纯的方法正确的是
A. 除去混在NO2中的NO:将气体与足量O2混合
B. 除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸
C. 除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D. 除去乙酸中混有的乙醇:加入生石灰后蒸馏
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl-
B. c(H+)/ c(OH-) = 1×10-12的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe3+) =1 mol·L-1的溶液中: Na+、NH4+、AlO2-、SO42-
D. 能使甲基橙变红的溶液中: K+、NH4+、SO42-、HCO3-
难度: 中等查看答案及解析
-
运动会上使用的发令枪所用的“火药”主要成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学反应方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述正确的是
A. 上述反应中氧化剂和还原剂的物质的量之比为6∶5
B. KCl既是氧化产物,又是还原产物
C. 上述反应中消耗3molP时,转移电子的物质的量为15mol
D. 因红磷和白磷互为同素异形体,上述火药中的红磷可以用白磷代替
难度: 中等查看答案及解析
-
一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+。下列叙述错误的是

A. Pd电极b为阴极
B. 阴极的反应式为:N2+6H++6e−
2NH3
C. H+由阳极向阴极迁移
D. 陶瓷可以隔离N2和H2
难度: 困难查看答案及解析
-
球墨铸铁中含有一种铁碳化合物X。实验室测定化合物X的组成实验如下:
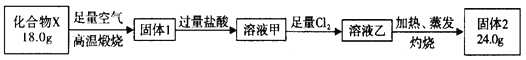
下列说法不正确的是
A. 固体2是氧化铁 B. X的化学式可以表示为Fe3C2
C. 溶液甲中可能含有Fe3+ D. X与足量的热浓硝酸反应有NO2和CO2生成
难度: 困难查看答案及解析
-
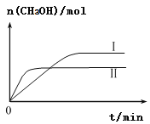
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
CH3OH(g)。一定条件下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生上述反应,则下列示意图合理的是 ( )
A.
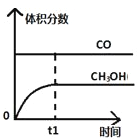 B.
B. 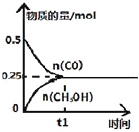 C.
C. 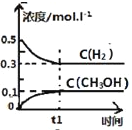 D.
D. 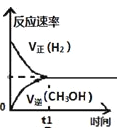
难度: 困难查看答案及解析
-
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
A. Na B. Al C. K D. Fe
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.
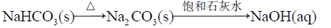
B.
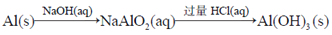
C.
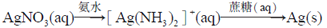
D.
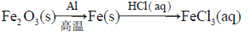
难度: 中等查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是
①过量的锌与18 mol·L-1的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③浓盐酸与过量的MnO2反应;④过量铜与浓硫酸反应;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石反应;⑦过量氯气与碘化钾溶液反应
A. ②③④⑥ B. ②③⑤⑦ C. ①③⑤ D. ①②③④⑥
难度: 中等查看答案及解析
-
将铁粉和铜粉的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO)。下列计算结果正确的是
编号
①
②
③
④
硝酸体积/mL
100
200
300
400
剩余金属/g
18.0
9.6
0
0
NO体积/L
2.24
4.48
6.72
V
A. ①中溶液存在Fe3+ B. 硝酸的浓度为4mol/L
C. ②中溶解了9.6gCu D. ④中V=6.72
难度: 困难查看答案及解析
-
下列说法正确的是
A. 根据反应Cu+H2SO4
CuSO4+H2↑可推出Cu的还原性比H2的强
B. 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C. 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D. 由置换反应I2+2NaClO3===2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
难度: 困难查看答案及解析
-
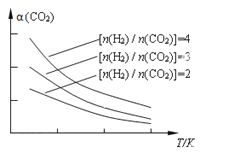
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)
2NO2(g)
②2NO2(g)
N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃。下列说法正确的是
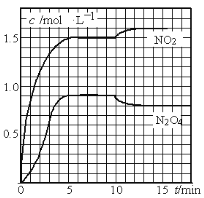
A. 前5min的平均反应速率v(N2O4)=0.18mol·L-1·s-1
B. T1℃时反应②的化学平衡常数K=0.6
C. 反应①、②均为吸热反应
D. 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10%
难度: 中等查看答案及解析
-
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO3-等离子的物质的量(mol)与反应时间t(min)的关系曲线。下列说法不正确的是
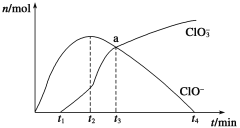
A. 工业制取漂白液的化学反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O
B. a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D. 使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
难度: 困难查看答案及解析