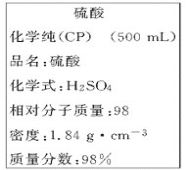
-
将一块铁片放入0.5L 1mol/L CuSO4溶液中,反应一段时间后,取出铁片,小心洗净后干燥称量,铁片增重0.8g,则反应后溶液中CuSO4的物质的量浓度是(反应前后溶液的体积不变)
A. 0.9 mol/L B. 0.85 mol/L C. 0.8 mol/L D. 0.75 mol/L
难度: 中等查看答案及解析
-
现有三组溶液:①汽油和氯化钠溶液 ②39%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 分液、蒸馏、萃取 D. 蒸馏、萃取、分液
难度: 简单查看答案及解析
-
某溶液中只含有Na+, Al3+,Cl-,SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和 SO42-的离子个数比为
A. 1:2 B. 1:4 C. 3:4 D. 3:2
难度: 中等查看答案及解析
-
古诗词是古人留给我们的宝贵财富,下列诗句中不涉及氧化还原反应的是
A. 春蚕到死丝方尽,蜡炬成灰泪始干
B. 粉身碎骨浑不怕,要留清白在人间
C. 爆竹声中一岁除,春风送暖入屠苏
D. 野火烧不尽,春风吹又生
难度: 简单查看答案及解析
-
大雾天气经常致使高速公路关闭,航班停飞。雾与下列分散系中属于同一类的是
A. 食盐水溶液 B. 碘的四氯化碳溶液 C. 泥水 D. 淀粉溶液
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述正确的是
A. 标准状况下,4.48L水中含有水分子的数目为0.2NA
B. 1molFe与足量水蒸气反应转移的电子数目为3NA
C. 0.2mol/LCaCl2溶液中含有氯离子的数目为0.4NA
D. 32 g O2和O3的混合气体所含原子数为2NA
难度: 中等查看答案及解析
-
下列实验操作中错误的是
A. 蒸发操作时,当蒸发皿中出现较多量的固体时,立即停止加热
B. 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 萃取操作时,选择的萃取剂与水不互溶,且萃取剂的密度必须比水大
难度: 中等查看答案及解析
-
某同学欲大量配制含有下列四种不同阴、阳离子的溶液,其中能配制成功的是
A. K+、H+、Cl-、CO32- B. Mg2+、Al3+、Cl-、SO42-
C. Na+、H+、NO3-、Fe2+ D. Na+、Ba2+、HCO3-、OH-
难度: 中等查看答案及解析
-
下列溶液的导电能力最强的是
A. 0.2 mol/L NaCl溶液 B. 0.15 mol/L MgCl2溶液
C. 0.2 mol/L BaCl2溶液 D. 0.25 mol/L HCl溶液
难度: 简单查看答案及解析
-
若m克Na在足量氯气中燃烧,生成固体的质量为(m+3.55)克,则m 克Na与氧气反应生成固体的质量可能为①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.4)g
A. ①④ B. ①⑤ C. ③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 金属铜与硝酸银溶液反应:Cu+Ag+ =Cu2++Ag
B. Ba(OH)2溶液和H2SO4溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3↓+3H+
D. 石灰乳与盐酸反应:Ca(OH)2+2H+ = Ca2++2H2O
难度: 中等查看答案及解析
-
溶质质量分数分别为a%和5a%的H2SO4溶液等体积混合均匀后,则混合溶液中H2SO4的质量分数为
A. 等于3a% B. 等于6a% C. 大于3a% D. 小于3a%
难度: 中等查看答案及解析
-
有相同条件下三个反应:①2A-+B2 =2B-+A2 ②2C-+A2=2A-+C2 ③2B-+D2=2D-+B2由此得出下列判断不正确的是
A. 氧化性:D2>B2> A2 > C2 B. 还原性:C->A->B->D-
C. 2A-+D2 =2D-+A2该反应可以进行 D. 2C-+B2 =2B-+C2该反应不能进行
难度: 中等查看答案及解析
-
在下列条件下,两种气体的分子数一定相等的是①同质量、不同密度的N2和CO ②同温度、同体积的O2和N2③不同温度压强下、同物质的量的CO2和H2O ④同密度、同体积的N2和O2
A. ①② B. ②③ C. ①③ D. ③④
难度: 中等查看答案及解析
-
用等体积等物质的量浓度的BaCl2溶液可使相同体积的Fe2(SO4)3 、FeSO4 、K2SO4三种溶液中的SO42-完全转化为沉淀,则三种溶液的物质的量浓度之比为( )
A. 1:3:3 B. 1:1:1 C. 3:1 :1 D. 1:2:3
难度: 中等查看答案及解析
-
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+ ;MnO4- →Mn2+ ;Cl2→2Cl- ;IO3-→I2 。如果分别用相同物质的量的这些物质氧化足量的KI,得到I2最多的是
A. Fe3+ B. MnO4- C. Cl2 D. IO3-
难度: 困难查看答案及解析
-
现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
A.+4 B.+3 C.+2 D.+1
难度: 中等查看答案及解析
-
将m g含氧化铁、氧化铜或氧化亚铁的样品投入物质的量浓度为1 mol/L的2 L盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是 ( )
A. (m-16)g B. (m+16)g
C. (m-32)g D. 16g
难度: 中等查看答案及解析
-
将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质质量分数为
A. 82a/(46a+m)% B. 8200a/(46a+2m) % C. 8200a/(46a+m)% D. 8200a/(69a+m) %
难度: 中等查看答案及解析
-
将足量CO2通入NaOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是
A.
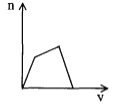 B.
B.  C.
C.  D.
D. 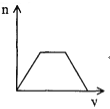
难度: 困难查看答案及解析
-
若
在强热时分解的产物是
、
、
和
,则该反应中化合价发生变化和未发生变化的N原子数之比为
A. 1:4 B. 1:2 C. 2:1 D. 4:1
难度: 简单查看答案及解析
-
标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3与CH4的体积比为a∶b,该混合气体对氢气的相对密度为D,则a∶b和D分别为( )
A. 1∶3 和7.5 B. 1∶6和6.4 C. 17∶16和7.5 D. 4:1和8.4
难度: 中等查看答案及解析
-
已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O ,下列说法正确的是
A. CuI既是氧化产物又是还原产物
B. 每转移1.1mol电子,有0.2molIO3-被氧化
C. 每生成1molCuI,有12molKI发生氧化反应
D. Cu(IO3)2作氧化剂,Cu(IO3)2中的铜和碘元素被还原
难度: 困难查看答案及解析
-
某CaCl2样品可能混有FeCl3、MgCl2、NaCl、Na2CO3中的一种或两种,取11.1克样品溶解,得无色溶液,再加入足量AgNO3溶液,得27.7克沉淀,由此可知样品中所含杂质的正确结论是
A.一定无Na2CO3,一定有MgCl2 B.一定无Na2CO3,一定有NaCl
C.一定有MgCl2,可能有NaCl D.一定有FeCl3,可能有NaCl
难度: 困难查看答案及解析