-
下列描述中,不符合生产实际的是( )
A. 电解熔融的氧化铝制取金属铝,用铁作阳极
B. 电解法精炼粗铜,用纯铜作阴极
C. 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D. 在镀件上电镀锌,用锌作阳极
难度: 中等查看答案及解析
-
下列有关能量转换的说法不正确的是( )
A. 煤燃烧是化学能转化为热能的过程
B. 太阳能热水器是太阳能转化为热能
C. 可充电电池在充电时是将电能转化为化学能,而放电时是化学能转化电能
D. 酸碱中和反应放出的能量可设计为原电池转化为电能
难度: 简单查看答案及解析
-
下列变化中,属于吸热反应的是( )
①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释 ④KClO3分解制O2⑤生石灰跟水反应生成熟石灰⑥石灰石高温分解⑦铝热反应⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O=CO+H2 ⑩Al与盐酸反应
A. ②③④⑥⑦⑧⑨ B. ②④⑥⑧⑨ C. ①②④⑥⑧ D. ②③④⑧⑨
难度: 简单查看答案及解析
-
利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
难度: 简单查看答案及解析
-
在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是
A. 2H2(g)+O2(g)= 2H2O(l) ΔH1 2H2(g)+O2(g) =2H2O(g) ΔH2
B. S(g)+O2(g) =2SO2(g) ΔH1 S(s)+O2(g) =2SO2(g) ΔH2
C. C(s)+1/2O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2
D. 2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2;
难度: 中等查看答案及解析
-
通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=206.1kJ·mol–1
A. 反应①中电能转化为化学能
B. 反应②为放热反应
C. 反应③使用催化剂,ΔH3减小
D. 反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1
难度: 困难查看答案及解析
-
下列事实不能用勒夏特列原理来解释的是
A. 用排饱和食盐水的方法收集氯气
B. 合成氨工业选择高温(合成氨反应为放热反应)
C. 增大压强,有利于SO2和O2反应生成SO3
D. 在Fe3++3SCN-
Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深
难度: 中等查看答案及解析
-
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质溶液是20%~30%的KOH溶液。电池总反应为:N2H4+O2=N2+2H2O。下列关于该燃料电池工作时的说法正确的是
A. 正极的电极反应式是:O2+4H++4e-→2H2O
B. 负极的电极反应式是:N2H4+4OH--4e-→4H2O+N2↑
C. 溶液中阴离子向正极移动
D. 放电后电解质溶液的碱性增强
难度: 中等查看答案及解析
-
已知2H2O2(l)=2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法错误的是( )

A. 该反应是放热反应
B. 途径Ⅱ与途径Ⅰ相比,可能是加了催化剂
C. 其他条件相同时,产生相同体积氧气放出的热量:途径Ⅰ>途径Ⅱ
D. 其他条件相间时,产生相同体积氧气所需的时间:途径Ⅰ>途径Ⅱ
难度: 困难查看答案及解析
-
“神舟七号”宇宙飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该电池可同时供应电和水蒸气,所用燃料为氢气,电解质为熔融的碳酸钾。该电池的总反应为2H2+O2 =2H2O,负极反应为H2 + CO32—→CO2↑ + H2O + 2e—,下列正确的是( )
A. 电池工作时,CO32—向负极移动
B. 电池放电时,外电路电子由通氧气的正极流向通氢气的负极
C. 正极的电极反应为:4OH—→O2↑+2H2O+4e—
D. 通氧气的电极为阳极,发生氧化反应
难度: 中等查看答案及解析
-
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(g)+B(g)
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法: ① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1 其中正确的是
A. ①③ B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
为了减缓锌和一定浓度盐酸反应速率,而又不减少产生氢气的量,向盐酸中加入下列物质,措施可行的是
A. 升温 B. NaNO3溶液 C. 几滴CuSO4溶液 D. CH3COONa固体
难度: 简单查看答案及解析
-
某温度下,反应2SO3(g)
2SO2(g) + O2(g)的平衡常数K1=4×10-4,在同一温度下,反应SO3 (g)
SO2(g)+ 1/2O2(g)的平衡常数K2的值为
A. 250 B. 200 C. 50 D. 2×10-2
难度: 简单查看答案及解析
-
500 ℃条件下,在恒容密闭容器中,充入1 mol NO2存在如下平衡:2NO2(g)
N2O4(g)。平衡后,向容器内再充入1 mol NO2,下列说法正确的是
A. 平衡向正反应方向移动 B. 平衡常数K增大
C. NO2的转化率变小 D. 容器内气体颜色先变深后变浅,最后比原来还要浅
难度: 中等查看答案及解析
-
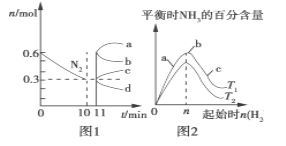
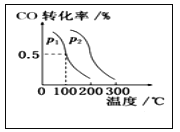
某研究小组研究了其他条件不变时,改变条件对可逆反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0的影响。下列说法正确的是

A. 图1研究的是温度、压强对平衡的影响,横轴表示压强
B. 图2研究的是温度对平衡的影响,Ⅱ采用的温度更低
C. 图3中t0时使用了催化剂,使平衡向正反应方向移动
D. 图4中t0时增大压强,使平衡向正反应方向移动
难度: 中等查看答案及解析
-
如右图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,正确的是( )
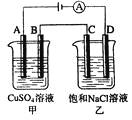
A. 甲烧杯中A极上最多可析出铜0.64g
B. 甲烧杯中B极上电极反应式4OH--4e-=2H2O+O2↑
C. 乙烧杯中滴入酚酞试液,D极附近先变红
D. 烧杯中C极上电极反应式为4H++4e-=2H2↑
难度: 中等查看答案及解析
-
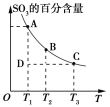
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是
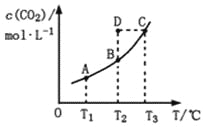
A. 反应CO(g)+H2O(g)
CO2(g)+H2(g)的ΔH>0
B. 在T2时,若反应处于状态D,则一定有ν正<ν逆
C. 平衡状态A与C相比,平衡状态A的c(CO)小
D. 若T1、T2时的平衡常数分别为K1、K2,则K1<K2
难度: 困难查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生如下反应:mX(g)
nY(g) ΔH=QKJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:下列说法不正确的是

A. 温度不变,压强增大,Y的质量分数减小
B. m>n
C. Q<0
D. 体积不变,温度升高,平衡向逆反应方向移动
难度: 中等查看答案及解析
 。
。