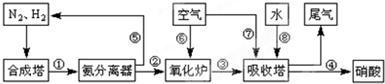
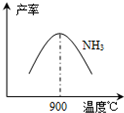
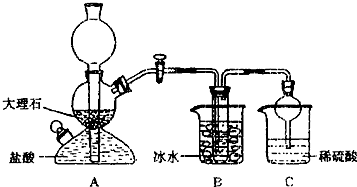
-
2010年上海世博会的主题是“城市,让生活更美好”.下列叙述中不正确的是( )
A.世博会中国馆--“东方之冠”使用的钢筋混凝土不属于复合材料
B.世博会前期,处理废水时加入明矾可作为净水剂以吸附水中的杂质
C.世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可减少白色污染的产生
D.世博会停车场安装催化光反应设施,可将汽车尾气中CO和NOx反应生成无毒气体难度: 中等查看答案及解析
-
下列表述正确的是( )
A.氯气溶于水的离子方程式是Cl2+H2O=2H++Cl-+ClO-
B.含有大量N03-的溶液中,可以同时大量存在H+、Fe2+、Cl-、SO42-
C.常温下在AgNO3溶液中滴加NaCl溶液至不再有白色沉淀生成,再滴加KI溶液,沉淀由白色变黄色,证明常温下AgCl溶解度大于AgI溶解度
D.若NA表示阿伏加德罗常数的值,1molC20H42的分子中含有的共价键数目为62NA难度: 中等查看答案及解析
-
下列说法正确的是( )
A.分子式为CH4O和C2H6O的物质一定互为同系物
B.甲烷、乙烯和苯在工业上都可通过石油分馏得到
C.苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠
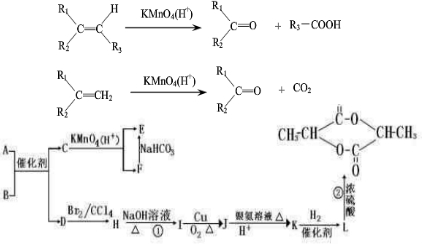
D.1mol 与足量的NaOH溶液加热充分反应,能消耗5molNaOH
与足量的NaOH溶液加热充分反应,能消耗5molNaOH 难度: 中等查看答案及解析
-
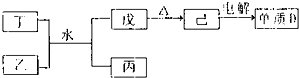
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如下图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大.)
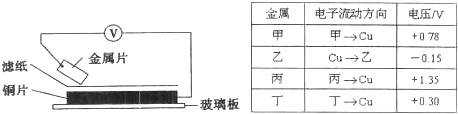
依据记录数据判断,下列结论中正确的是( )
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极难度: 中等查看答案及解析
-
某无色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO2-3、⑥SO2-4-离子中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
根据上述实验现象,判断以下结论中正确的是( )步骤 操作 现象 ① 用pH试纸检验 溶液的pH大于7 ② 向溶液中滴加氯水,再加入CCl4振荡,静置 CCl4层呈橙红色 ③ 取②的上层溶液,加入Ba(NO3)2溶液和稀HNO3 有白色沉淀产生 ④ 将③过滤,向滤液中加入AgNO3溶液和稀HNO3 有白色沉淀产生
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①②⑥
D.不能确定的离子是①③⑥难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(Na+)>c(B-)>c(H+)>c(OH-)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3•H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)难度: 中等查看答案及解析
-
关于下列各图的叙述,正确的是( )
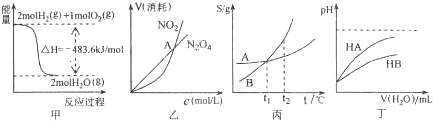
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj•mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2⇔N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液难度: 中等查看答案及解析