-
PbO2、KMnO4、Cl2、FeCl3、Cu2+的氧化性依次减弱。下列反应在水溶液中不可能发生的是
A. Cu+2Fe3+=Cu2++2Fe2+
B. 10Cl−+2MnO4−+16H+=2Mn2++5Cl2↑+8H2O
C. 2Fe2++Cl2=2Fe3++2Cl−
D. 5Pb2++2MnO4−+2H2O=5PbO2+2Mn2++4H+
难度: 困难查看答案及解析
-
用10 mL的0.1 mol·L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是
A. 3∶2∶2 B. 1∶2∶3 C. 1∶3∶3 D. 3∶1∶1
难度: 中等查看答案及解析
-
下列有关实验安全问题的叙述中正确的是
A. 少量的浓硫酸沾到皮肤上时,直接用大量的水冲洗,再涂上硼酸溶液
B. 用酒精灯给玻璃仪器直接加热时,应先移动酒精灯进行预热后再集中加热。
C. 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
D. H2还原CuO的实验结束时,应先停止通氢气,再撤走加热氧化铜的酒精灯。
难度: 简单查看答案及解析
-
下列实验操作中正确的是
A. 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B. 蒸馏操作时,应在蒸馏烧瓶中预先加入沸石,并使温度计水银球浸没在所蒸馏的液体混合物中。
C. 分液操作过程中,应关闭分液漏斗上端的塞子,防止有机试剂挥发,造成环境污染。
D. 萃取操作时,振荡分液漏斗的过程中应及时放气。
难度: 简单查看答案及解析
-
海盐经溶解、过滤后仍含有Ca2+、Mg2+、SO42—等可溶性杂质,为了得到纯净的NaCl,可向滤液中依次加入过量的下列溶液,其中不合理的是
A. BaCl2→NaOH→NaCO3→过滤→稀盐酸→蒸发结晶
B. Ba(OH)2→NaCO3→过滤→稀盐酸→蒸发结晶
C. NaCO3→NaOH→BaCl2→过滤→稀盐酸→蒸发结晶
D. BaCl2→NaCO3→NaOH→过滤→稀盐酸→蒸发结晶
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 1 mol N2所含有的原子数为NA
B. 标准状况下,22.4 L水中含有的水分子数为NA
C. 500 mL 1.0 mol/L碳酸钠溶液中所含钠离子的数为NA
D. 0.5mol纯硫酸所含有的氧原子数与2NA个CO2分子中所含有的氧原子数相等
难度: 中等查看答案及解析
-
标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是
A. 体积大小: ④>③>②>① B. 原子数目: ③>①>④>②
C. 密度大小: ④>②>③>① D. 质量大小: ④>③>②>①
难度: 简单查看答案及解析
-
标准状况下将44.8LHCl气体溶于1L水中,所得盐酸溶液的密度为1.1g/cm3,该盐酸的物质的量浓度为
A. 2mol/L B. 2.1mol/L C. 2.2mol/L D. 2.3mol/L
难度: 简单查看答案及解析
-
符合下图中阴影部分的物质是( )

A. CO2 B. Cu2O
C. NO2 D. Na2O
难度: 简单查看答案及解析
-
下列对胶体的相关说法,错误的是
①利用胶体的性质,可用高压直流电除去水泥厂和冶金厂的大量烟尘,减少对空气的污染
②向饱和FeCl3溶液中滴加NaOH溶液,可制得Fe(OH)3胶体
③一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路,则能说明该蛋白质溶液是胶体。
④往Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
⑤用血液透析的方法治疗肾功能衰竭等疾病引起的血液中毒,利用的是胶体渗析的原理
⑥Fe(OH)3胶体电泳实验中阴极颜色加深,说明Fe(OH)3胶体带正电
⑦同一支钢笔先后吸入不同牌子的墨水易造成钢笔堵塞,是因为不同牌子的墨水混用易聚沉。
A. ①②④⑦ B. ②④⑥⑦ C. ②⑥ D. ①③④⑤⑦
难度: 简单查看答案及解析
-
磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子的直径为5.5∼36nm的磁流体。下列说法中正确的是
A. 所得到的分散系属于胶体
B. 用一束光照射该分散系时,看不到一条光亮的“通路”
C. 该分散系不能透过滤纸
D. 该分散系的分散质为Fe(OH)3
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B. NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C. 铜、石墨均导电,所以它们是电解质
D. 蔗糖、酒精在水溶液或熔化时均不导电,所以它们是非电解质
难度: 中等查看答案及解析
-
下列物质混合发生化学反应,且反应属于离子反应的是
A. H2和O2反应生成水
B. 锌片投入稀硫酸中
C. KClO3(固体)和MnO2(固体)混合加热制O2
D. NaOH溶液和K2SO4溶液混合
难度: 简单查看答案及解析
-
在某无色酸性溶液中能大量共存的一组离子是
A. NH4+ 、SO42- 、Al3+ 、NO3- B. Na+ 、K+ 、HCO3- 、NO3-
C. Na+ 、Ca2+ 、NO3- 、CO32- D. K+、Cu2+ 、NH4+ 、NO3-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. 铁与盐酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
B. 氢氧化钡与硫酸铜溶液混合:2OH- + Cu2+ = Cu(OH)2↓
C. 过量NaHCO3溶液和少量Ba(OH)2反应:2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O
D. 石灰乳和盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
以下反应属于氧化还原反应,且H2O既不是氧化剂也不是还原剂的是
A. 2Na+2H2O=2NaOH+H2↑ B. 2F2+2H2O=4HF+O2↑
C. CaO+H2O=Ca(OH)2 D. Cl2+H2O=HCl+HClO
难度: 简单查看答案及解析
-
以下各组物质所具有的性质依次为只有氧化性、只有还原性、既有氧化性又有还原性的是
A. Na、H+、H2O B. Cl2、KClO3、Fe
C. Na+、K、Fe2+ D. KMnO4、CO、H2O
难度: 简单查看答案及解析
-
下列反应中,电子转移的表示方法正确的是
A.
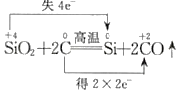 B.
B. 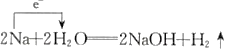 C.
C. 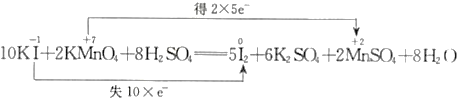 D.
D. 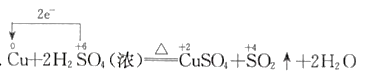
难度: 中等查看答案及解析
-
硫代硫酸钠(Na2S2O3)可作为脱氯剂,已知25.0mL 0.100 mol·L-1的Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化为( )
A. S2- B. S C. SO32- D. SO42-
难度: 中等查看答案及解析
