-
含NaOH 20.0g的稀溶液与足量的稀盐酸反应,放出28.7kJ的热量,表示该反应中和热的热化学方程式正确的是( )
A. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=+28.7kJ/mol
B. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-28.7kJ/mol
C. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=+57.4kJ/mol
D. NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.4kJ/mol
难度: 中等查看答案及解析
-
已知:H2(g)+F2(g)=2HF(g) △H=—270kJ/mol,下列说法正确的是( )
A. 2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量
B. 1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJ
C. 在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量
D. 1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量
难度: 中等查看答案及解析
-
据报道,某国一集团拟在太空建造巨大的集光装置,把太阳光变成激光用于分解海水制氢:2H2O==== 2H2↑+O2↑ ,下列说法中正确的是
A. 水的分解反应是放热反应
B. 氢气是一级能源
C. 使用氢气作燃料有助于控制温室效应
D. 此反应的目的是用生成的氢气与空气中多余的CO2反应生成甲醇储存起来,改善生存环境
难度: 简单查看答案及解析
-
对于反应3A=2B,根据下图,下列说法不正确的是( )
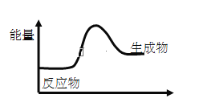
A. 该反应为吸热反应
B. 该反应一定有能量转化成了化学能
C. 反应物比生成物稳定
D. 因为生成物的总能量高于反应物的总能量,所以该反应不需要加热
难度: 中等查看答案及解析
-
已知:(1)Zn(s)+1/2O2(g)====ZnO(s)ΔH=﹣348.3 kJ·
(2)2Ag(s)+1/2O2(g)====Ag2O(s)ΔH=﹣31.0 kJ·
则Zn(s)+Ag2O(s)====ZnO(s)+2Ag(s)的ΔH等于( )
A. ﹣317.3 kJ·
B. ﹣379.3 kJ·
C. ﹣332.8 kJ·
D. +317.3 kJ·
难度: 中等查看答案及解析
-
铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
A. 加入适量的铝粉 B. 加入适量的水
C. 加入少量的硫酸铜溶液 D. 加入浓度较大的盐酸
难度: 中等查看答案及解析
-
在四个相同的容器中,在不同的温度下(其它条件相同)进行合成氨的反应,根据下列在相同时间内测得的结果判断,该反应所处的温度最高的是( )
A. v(NH3)=0.1 mol /(L•min) B. v (H2)=0.6 mol /(L•min)
C. v (N2)=0.3 mol /(L•min) D. v (H2)=0.3 mol /(L•min)
难度: 简单查看答案及解析
-
在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)
C(g)+D(g)已达平衡的是
A.混合气体的压强 B.混合气体的密度
C.混合气体的分子数目 D.混合气体的总物质的量
难度: 中等查看答案及解析
-
在密闭容器中,反应xA(g)+yB(g)
zC(g)达平衡时,A的浓度为0.5mol/L若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是( )
A. x+y<z B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=c(CO)c(H2O)/c(CO2)c(H2)。恒容时,温度升高,H2浓度减小。下列说法正确的是
A. 该反应化学方程式为CO+H2O
CO2+H2 B. 升高温度,逆反应速率减小
C. 恒温恒容下,增大压强,H2浓度一定减小 D. 该反应是焓变为正值
难度: 中等查看答案及解析
-
分析下列反应在任何温度下均能自发进行的是(
A. 2N2(g)+O2(g)=2N2O(g) △H = +163 kJ•mol-1
B. H2O2(l)=1/2O2(g)+H2O(l) △H =-98 kJ•mol-1
C. HgO(s)=Hg(l)+1/2O2(g) △H =+91 kJ•mol-1
D. Ag(s)+1/2Cl2(g)=AgCl(s) △H =-127 kJ•mol-1
难度: 中等查看答案及解析
-
某浓度的氨水中存在下列平衡:NH3·H2O
NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是
①适当升高温度;②加入NH4Cl固体;③通入NH3;④加入少量盐酸
A. ①② B. ②③ C. ②④ D. ①④
难度: 中等查看答案及解析
-
室温时,下列混合溶液的pH一定小于7的是( )
A. pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
B. pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合
C. pH=3的盐酸和pH=11的氨水等体积混合
D. pH=3的硫酸和pH=11的氨水等体积混合
难度: 简单查看答案及解析
-
反应mA(g)+nB(g)
pC(g)+qD(g)经10 min后达到平衡,测得此时A的浓度减少了nmol/L,C的浓度增加了2n/3mol/L,又知,平均反应速率VC=2VB.达到平衡后,若保持温度不变,缩小容器体积,A的转化率不变,则该反应的化学方程式应为
A. 2A(g)+6B(g)
3C(g)+5D(g)
B. 3A(g)+B(g)
2C(g)+2D(g)
C. 3A(g)+B(g)
2C(g)+D(g)
D. A(g)+3B(g)
3C(g)+3D(g)
难度: 简单查看答案及解析
-
在不同温度下(T1 <T2),可逆反应2X(g)
2Y(g)+Z(g) ΔH<0中,生成物Z在反应平衡混合物中的体积分数(
)与反应时间(t)的关系有以下图示,正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应: 2A(g)+B(g)
2C(g)。若经2 s后测得C的浓度为0.6 mol·L-1,下列几种说法正确的是( )
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应平均速率为0.3 mol·L-1·s-1
③2 s时物质A的转化率为70%④2 s时物质B的浓度为0.7 mol·L-1
A. ①③ B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析


